Nghiên cứu thành phần phân lớp giáp xác chân chèo (Copepoda) tại sông Vu Gia - Thu Bồn, Quảng Nam
Giáp xác chân chèo (Copepoda) đóng vai quan trọng trong hệ sinh thái các thủy vực nước ngọt, là một
trong 3 nhóm chính của động vật phù du (Zooplankton), bên cạnh Trùng bánh xe (Rotifera) và Giáp xác
râu (Cladocera). Nghiên cứu đã ghi nhận được 10 loài thuộc phân lớp Copepoda thuộc 9 chi, 6 họ và 3 bộ.
Trong đó, 1 chi và 2 loài ghi nhận mới cho khu hệ phân lớp giáp xác ở Việt Nam. Kết quả của nghiên cứu
cũng cho thấy các thông số môi trường có ảnh hưởng đến mật độ Copepoda, trong đó, mô hình tường quan
đa biến (CCA) cho thấy các thông số môi trường của nước mặt như EC, TDS, NO2- và PO43- ảnh hưởng đến
các loài Schmackeria bulbosa, Thermocyclops crassus, Mesocyclops leuckarti với lần lượt là -0.87, -0.24,
-0.64. Bên cạnh đó, trong môi trường nước trong cát, thông số PO43- ảnh hưởng đến loài Parastenocaris
sp.2 là -2.0 và mật độ loài Mesochra pseudoparva có mối tương quan nghịch đối với thông số EC và TDS
với cùng hệ số -2.15.

Trang 1

Trang 2
Trang 3

Trang 4

Trang 5
Tóm tắt nội dung tài liệu: Nghiên cứu thành phần phân lớp giáp xác chân chèo (Copepoda) tại sông Vu Gia - Thu Bồn, Quảng Nam

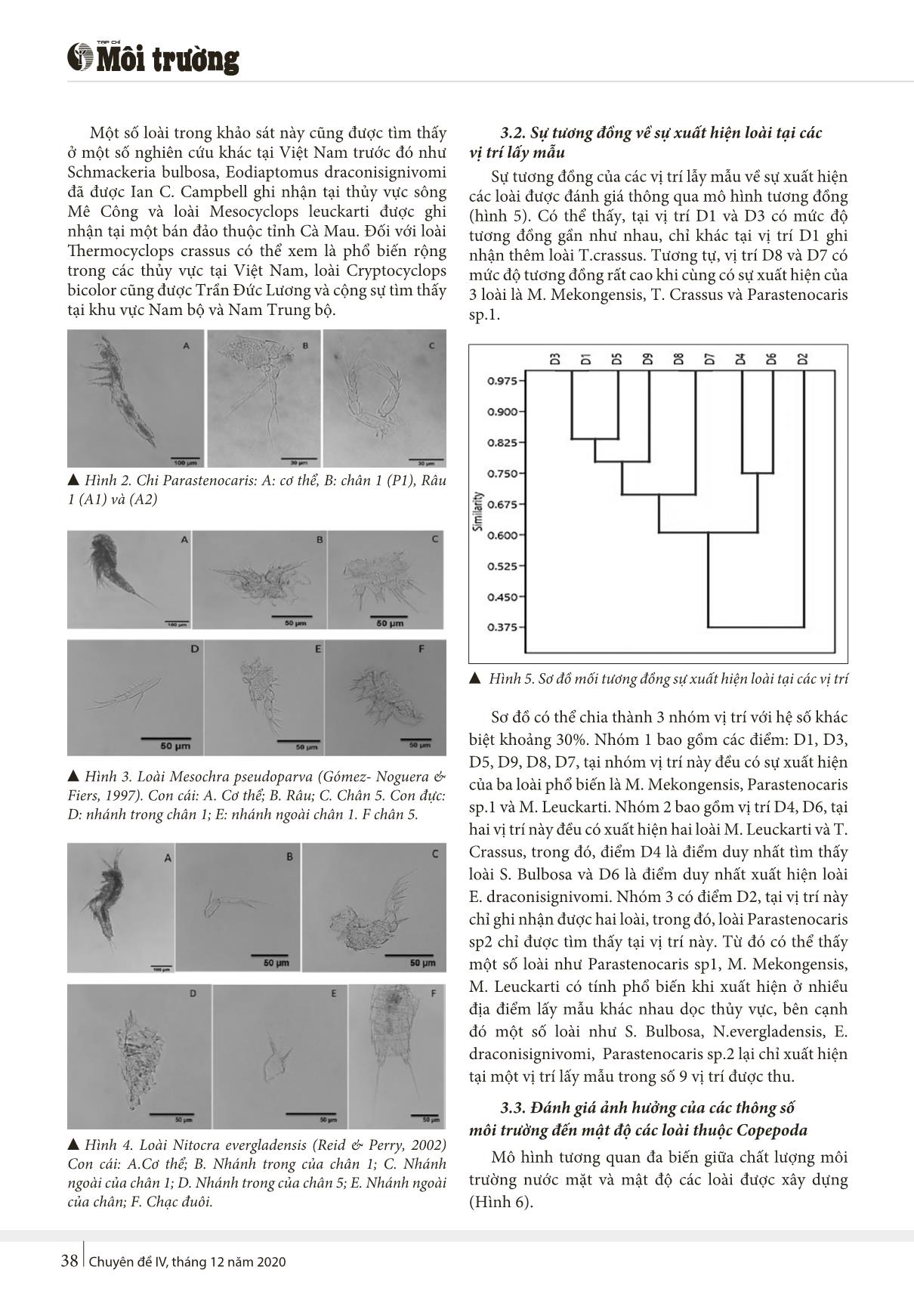
Chuyên đề IV, tháng 12 năm 202036 NGHIÊN CỨU THÀNH PHẦN PHÂN LỚP GIÁP XÁC CHÂN CHÈO (COPEPODA) TẠI SÔNG VU GIA - THU BỒN, QUẢNG NAM TÓM TẮT Giáp xác chân chèo (Copepoda) đóng vai quan trọng trong hệ sinh thái các thủy vực nước ngọt, là một trong 3 nhóm chính của động vật phù du (Zooplankton), bên cạnh Trùng bánh xe (Rotifera) và Giáp xác râu (Cladocera). Nghiên cứu đã ghi nhận được 10 loài thuộc phân lớp Copepoda thuộc 9 chi, 6 họ và 3 bộ. Trong đó, 1 chi và 2 loài ghi nhận mới cho khu hệ phân lớp giáp xác ở Việt Nam. Kết quả của nghiên cứu cũng cho thấy các thông số môi trường có ảnh hưởng đến mật độ Copepoda, trong đó, mô hình tường quan đa biến (CCA) cho thấy các thông số môi trường của nước mặt như EC, TDS, NO2- và PO43- ảnh hưởng đến các loài Schmackeria bulbosa, Thermocyclops crassus, Mesocyclops leuckarti với lần lượt là -0.87, -0.24, -0.64. Bên cạnh đó, trong môi trường nước trong cát, thông số PO43- ảnh hưởng đến loài Parastenocaris sp.2 là -2.0 và mật độ loài Mesochra pseudoparva có mối tương quan nghịch đối với thông số EC và TDS với cùng hệ số -2.15. Từ khóa: Copepoda, đa dạng sinh học, Vu Gia - Thu Bồn, Quảng Nam. Nhận bài: 7/12/2020; Sửa chữa: 14/12/2020; Duyệt đăng: 25/12/2020. 1. Giới thiệu Phân lớp giáp xác chân chèo (Copepoda) thuộc lớp chân hàm Maxillopoda Dahl, là một trong những nhóm phù du chiếm ưu thế trong các thủy vực hiện nay trên thế giới đã xác định với hơn 13.000 loài được mô tả (Boxshall and Defaye 2008). Copepoda phân bố khá rộng ở nhiều dạng thủy vực khác nhau, từ nước ngọt, nước lợ, nước mặn đến các dạng môi trường đặc biệt như trong cát và nền đáy (Brancelj, Žibrat, and Jamnik 2016; Meleg et al. 2012). Các loài thuộc Copepoda đóng vai trò là mắt xích rất quan trọng trong việc chuyển tiếp năng lượng từ sinh vật sản xuất sơ cấp đến cấp dinh dưỡng cao hơn trong các thủy vực (Turner 2004). Bên cạnh đó, Copepoda được xem là nhóm loài nhạy cảm với sự thay đổi của các yếu tố môi trường sống, bao gồm yếu tố vật lý, hóa học và sinh học (Tian et al. 2017). Chính vì vậy, đây là nhóm sinh vật có giá trị dùng làm chỉ thị để đánh giá chất lượng môi trường nước. Tại các thủy vực nước ngọt, nhiều nghiên cứu về Copepoda đã ghi nhận hơn 2.800 loài giáp xác chân chèo chủ yếu thuộc 3 bộ Calanoida, Harpacticoida, Cyclopoida, phân bố ở nhiều dạng thủy vực từ sông, hồ, sinh cảnh cát cho đến trong nước ngầm (Boxshall and Defaye 2008). Trên thế giới, nghiên cứu về Copepoda tại các thủy vực nước ngọt đáng chú ý Brancelj (Brancelj 2002, n.d.; Brancelj et al. 2016; Liu and Brancelj 2014), Boxshall (Boxshall and Defaye 2008; Boxshall and Schminke 1988) Sendacz (2001), Streletskaya (2010), Cowell (1967). Tuy nhiên, các nghiên cứu về Copepoda trong sinh cảnh cát còn khá ít và chủ yếu nhiên cứu nhiều về Trùng bánh xe (Rotifer). Đối với sinh cảnh cát ven sông, suối và hồ được xem là môi trường khá đặc biệt, có sự đa dạng của các nhóm vi khuẩn, tảo, động vật nguyên sinh, Copepoda (Pennak 1951). Sinh cảnh cát được chia thành phần như sau: Hydropsammon là khu vực cát ngập chìm hoàn toàn trong nước; Hygropsammon là khu vực cát bán ngập chìm và chỉ bị ướt một phần do sự giao động của nước; Eupsammon là khu vực cát bên ngoài cùng. Nhóm Copepoda đặc trưng trong cát là bộ Harpacticoida (Horvath, Whitman, and Last 2001). 1 Trường Đại học Sư phạm – Đại học Đà Nẵng Trần Ngọc Sơn, Phạm THị Phương Trịnh Đăng Mậu, Trần Nguyễn Quỳnh Anh Võ Văn Minh, Đàm Minh Anh Phan THị Hoa (1) KẾT QUẢ NGHIÊN CỨU KHOA HỌC VÀ ỨNG DỤNG CÔNG NGHỆ Chuyên đề IV, tháng 12 năm 2020 37 Tại Việt Nam, các nghiên cứu về Copepoda chủ yếu được thực hiện trong những năm gần đây của nhóm nghiên cứu Trần Đức Lương, kết hợp với một số nhà nghiên cứu trên thế giới. Các nghiên cứu này đã phát hiện nhiều loài mới cho khoa học như Hadodiaptomus dumonti, Mesocyclops sondoongensis sp. nov., Microarthridion thanhi n. sp., Nitocra vietnamensis n. sp., Nannodiaptomus haii sp. nov. (Tran and Brancelj 2017; Tran and Chang 2012; Tran and Hołyńska 2015) và chỉ có một nghiên cứu về ảnh hưởng của yếu tố NH4+ và PO43- đến số lượng, mật độ các loài giáp xác tại khu vực Vườn quốc gia Phong Nha - Kẻ Bàng (Minh 2018). Vì vậy, nghiên cứu này nhằm khảo sát thành phần Copepoda tại sông Vu Gia - Thu Bồn, Quảng Nam và đánh giá ảnh hưởng của các yếu tố môi trường đến mật độ của các loài thuộc Copepoda. 2. Phương pháp nghiên cứu 2.1. Phương pháp thu mẫu và phân loại Copepoda Nghiên cứu tiến hành tại 9 điểm dọc sông Vu Gia - Thu Bồn (Hình 1), thời gian thu mẫu được tiến hành vào tháng 7 và tháng 11/2019. Tại mỗi điểm sẽ thu Copepods ở những vùng nước gần bờ và trong nước ngầm ở các sinh cảnh cát sát mép sông. Mẫu định tính Copepods trong nước được thu bằng lưới thu động vật phù du với mắt lưới 50 μm và mẫu định lượng được thu bằng cách lọc 20 lít nước qua lưới thu mẫu. Mẫu định tính Copepods trong sinh cảnh cát thu bằng đào các hố cát có độ sâu khoảng 20 cm gần mép nước, sau đó lọc nước trong cát bằng bình lọc Zooplankton với mắt lưới 60 μm theo phương pháp của Branceij (2004). Mẫu định lượng Copepods trong cát được thu theo ô tiêu chuẩn có kích thước 30 cm x 30 cm, toàn bộ cát được cho vào xô nhựa sau đó trộn với nước đã lọc, rồi lọc bằng dụng cụ chuyện dụng như mẫu định tính. Mẫu Copepods được bảo quản bằng ethanol 70% trong bình đựng mẫu 50 ml chuyên dụng. Mẫu Copepods được giải phẫu và phân loại dưới kính hiển vi huỳnh quang Carl Zeiss Axio Lab A1 (Đức). Định danh loài theo các tài liệu phân loại của Wells (2007), Thorp (2017), Błędzki (2016), Defaye (2001). Mật độ của mỗi loài Copepods được xác định bằng buồng đếm sinh vật phù du Sedgewick - Raffer. ▲Hình 1. Sơ đồ khu vực nghiên cứu 2.2. Phương pháp thu và phân tích mẫu nước Mẫu được thu, bảo quản theo TCVN 6663-3:2003 và được đưa về phòng thí nghiệm để phân tích ngay sau khi thu. Các thông số pH, Ôxy hòa tan (DO), độ đục (NTU), độ dẫn điện (EC), tổng chất rắn hòa tan (TDS) được đo bằng thiết bị YSI 6920V2. Các thông số Amoni (NH4+), Nitrat (NO3), Nitrit (NO2-), Photphat (PO43-) phân tích tích theo các TCVN tại phòng thí nghiệm. 2.3. Phương pháp xử lý số liệu Đánh giá sự tương đồng giữa những vị trí lấy mẫu bằng phân tích cụm Clustering và ảnh hưởng của các thông số môi trường đến mật độ các loài thuộc Copepoda bằng phương pháp phân tích tương quan đa biến Canonical Correspondence Analysis (CCA). Các phân tích được thực hiện trên phần mềm thống kê PAST 4.03. 3. Kết quả và thảo luận 3.1. Thành phần loài Copepoda Kết quả nghiên cứu ghi nhận được 10 loài thuộc 6 họ của 3 bộ Calanoida, Cyclopoida và Harpacticoida (Bảng 1). Trong đó, ghi nhận được hai loài mới cho khu hệ giáp xác Việt Nam là Nitocra evergladensis (Reid & Perry, 2002) thuộc họ Ameiridae và Mesochra pseudoparva (Gómez- Noguera & Fiers, 1997 thuộc họ Canthocamptidae. Ngoài ra, nghiên cứu còn ghi nhận thêm sự xuất hiện của chi mới cho Việt Nam là Parastenocaris. Bảng 1. THành phần loài giáp xác chân chèo (Copepoda) ở sông Vu Gia - THu Bồn Bộ Calanoida Sars Họ Họ Pseudodiaptomidae Sars 1. Schmackeria bulbosa Shen & Tai, 1964 Họ Diaptomidae Sars 2. Mongolodiaptomus mekongensis Sanoamuang & Watiroyram, 2018 3. Eodiaptomus draconisignivomi Brehm, 1952 Bộ Cyclopoida Burmeister Họ Cyclopidae Rafinesque 4. Mesocyclops leuckarti (Claus, 1857) 5. Thermocyclops crassus (Fischer, 1853) 6. Cryptocyclops bicolor (Sars GO, 1863) Bộ Harpacticoida Sars Họ Ameiridae 7. Nitocra evergladensis Reid & Perry, 2002 Họ Canthocamptidae 8. Mesochra pseudoparva Gómez- Noguera & Fiers,1997 Họ Parastenocarididae (Chappuis, 1940) 9. Parastenocaris sp.1 10. Parastenocaris sp.2 Chuyên đề IV, tháng 12 năm 202038 Một số loài trong khảo sát này cũng được tìm thấy ở một số nghiên cứu khác tại Việt Nam trước đó như Schmackeria bulbosa, Eodiaptomus draconisignivomi đã được Ian C. Campbell ghi nhận tại thủy vực sông Mê Công và loài Mesocyclops leuckarti được ghi nhận tại một bán đảo thuộc tỉnh Cà Mau. Đối với loài Thermocyclops crassus có thể xem là phổ biến rộng trong các thủy vực tại Việt Nam, loài Cryptocyclops bicolor cũng được Trần Đức Lương và cộng sự tìm thấy tại khu vực Nam bộ và Nam Trung bộ. ▲Hình 2. Chi Parastenocaris: A: cơ thể, B: chân 1 (P1), Râu 1 (A1) và (A2) ▲Hình 3. Loài Mesochra pseudoparva (Gómez- Noguera & Fiers, 1997). Con cái: A. Cơ thể; B. Râu; C. Chân 5. Con đực: D: nhánh trong chân 1; E: nhánh ngoài chân 1. F chân 5. ▲Hình 4. Loài Nitocra evergladensis (Reid & Perry, 2002) Con cái: A.Cơ thể; B. Nhánh trong của chân 1; C. Nhánh ngoài của chân 1; D. Nhánh trong của chân 5; E. Nhánh ngoài của chân; F. Chạc đuôi. 3.2. Sự tương đồng về sự xuất hiện loài tại các vị trí lấy mẫu Sự tương đồng của các vị trí lẫy mẫu về sự xuất hiện các loài được đánh giá thông qua mô hình tương đồng (hình 5). Có thể thấy, tại vị trí D1 và D3 có mức độ tương đồng gần như nhau, chỉ khác tại vị trí D1 ghi nhận thêm loài T.crassus. Tương tự, vị trí D8 và D7 có mức độ tương đồng rất cao khi cùng có sự xuất hiện của 3 loài là M. Mekongensis, T. Crassus và Parastenocaris sp.1. ▲ Hình 5. Sơ đồ mối tương đồng sự xuất hiện loài tại các vị trí Sơ đồ có thể chia thành 3 nhóm vị trí với hệ số khác biệt khoảng 30%. Nhóm 1 bao gồm các điểm: D1, D3, D5, D9, D8, D7, tại nhóm vị trí này đều có sự xuất hiện của ba loài phổ biến là M. Mekongensis, Parastenocaris sp.1 và M. Leuckarti. Nhóm 2 bao gồm vị trí D4, D6, tại hai vị trí này đều có xuất hiện hai loài M. Leuckarti và T. Crassus, trong đó, điểm D4 là điểm duy nhất tìm thấy loài S. Bulbosa và D6 là điểm duy nhất xuất hiện loài E. draconisignivomi. Nhóm 3 có điểm D2, tại vị trí này chỉ ghi nhận được hai loài, trong đó, loài Parastenocaris sp2 chỉ được tìm thấy tại vị trí này. Từ đó có thể thấy một số loài như Parastenocaris sp1, M. Mekongensis, M. Leuckarti có tính phổ biến khi xuất hiện ở nhiều địa điểm lấy mẫu khác nhau dọc thủy vực, bên cạnh đó một số loài như S. Bulbosa, N.evergladensis, E. draconisignivomi, Parastenocaris sp.2 lại chỉ xuất hiện tại một vị trí lấy mẫu trong số 9 vị trí được thu. 3.3. Đánh giá ảnh hưởng của các thông số môi trường đến mật độ các loài thuộc Copepoda Mô hình tương quan đa biến giữa chất lượng môi trường nước mặt và mật độ các loài được xây dựng (Hình 6). KẾT QUẢ NGHIÊN CỨU KHOA HỌC VÀ ỨNG DỤNG CÔNG NGHỆ Chuyên đề IV, tháng 12 năm 2020 39 ▲Hình 6. Ảnh hưởng các thông số môi trường nước mặt với mật độ các loài Kết quả cho thấy, các thông số EC, TDS, NO2- và PO43- có ảnh hưởng đến số lượng của loài S. bulbosa, T. crassus và M. leuckarti. Cụ thể, mật độ ba loài S. bulbosa, T. crassus và M. leuckarti có mối tương quan nghịch với các thông số EC, TDS, NO2- và PO43- với hệ số tương quan trên trục CCA 1 lần lượt là -0.87, -0.24 và -0.64. Một nghiên cứu khác của Natasˇ a Mori và Anton Brancelj về môi trường sống của các loài thuộc chi Elaphoidella cũng cho thấy, thông số EC có mối tương quan nghịch đối với sự xuất hiện của các loài thuộc chi này (Mori and Brancelj 2008). Trong một nghiên cứu của Campus Sterre về sự phân bố không gian và thời gian của bộ Harpacticoida ở cửa sông Mondego, Bồ Đào Nha cho thấy, sự xuất hiện của các loài thuộc Harpacticoida liên quan đến các biến môi trường là (NO3-, PO43-, NH4+, pH, nhiệt độ, ▲Hình 7. Ảnh hưởng của các thông số môi trường nước trong cát đến mật độ các loài TSS). Nghiên cứu còn chỉ ra rằng, loài Microsetella sp., và Euterpina acutifrons có liên quan đến nồng độ tối đa của NO2- và TSS; loài Macrosetella gracilis và Parapseudoleptomesochra sp. có mối tương quan cao với Si và PO43- (Gonçalves et al. 2010). Sự tương quan giữa chất lượng môi trường nước ngầm trong cát với mật độ các loài được đánh giá thông qua mô hình tương quan đa biến giữa các thông số môi trường nước ngầm trong cát và mật độ các loài ghi nhận được tại khu vực sông Vu Gia - Thu Bồn (Hình 7). Qua đó cho thấy, loài Parastenocaris sp.2 cũng có mối tương quan nghịch với thông số PO43- với hệ số tương quan trên trục CCA 1 là -2.0. Ngoài ra, xét trên trục CCA 2 có thể thấy sự xuất hiện của loài M.pseudoparva có mối tương quan nghịch đối với thông số EC và TDS với hệ số tương quan là -2.15. Một nghiên cứu khác của Karuthapandi về động vật phù du sống trong các ao nước ngọt tại Ấn Độ chứng minh, các loài thuộc Copepoda có mối tương quan cao với các thông số như PO43-, nhiệt độ, DO, NO2-, NO3- (Karuthapandi, Xavier Innocent, and Siddiqi 2012). Mật độ và số lượng các loài Copepods có sự ảnh hưởng khá lớn bởi các thông số môi trường như EC, TDS, NO2- và PO43- có thể được giải thích là do các thông số này ảnh hưởng đến quá trình axit hóa và phú dưỡng của môi trường nước, điều này ảnh hưởng đến sự suy giảm số lượng và mật độ các loài Copepods (Stalder & Marcus, 1997; Park & Marshall, 2000). 4. Kết luận Nghiên cứu tiến hành thu mẫu tại 9 điểm thuộc sông Vu Gia - Thu Bồn, Quảng Nam đã ghi nhận được 10 loài thuộc 3 bộ Calanoida, Cyclopoida và Harpacticoida. Trong đó, nghiên cứu đã bổ sung được 1 chi, 2 loài mới bổ sung cho khu hệ giáp xác của Việt Nam. Kết quả nghiên cứu cũng cho thấy các thông số môi trường như EC, TDS, NO2- và PO43- có ảnh hưởng đến mật độ Copepods. Lời cảm ơn: Nghiên cứu này được thực hiện từ nguồn kinh phí hỗ trợ Bộ Giáo dục và Đào tạo trong đề tài có mã số B2019-DNA-05■ TÀI LIỆU THAM KHẢO 1. Boxshall, G. A., and H. K. Schminke. 1988. Biology of Copepods. 2. Boxshall, Geoff A., and Danielle Defaye. 2008. “Global Diversity of Copepods (Crustacea: Copepoda) in Freshwater.” Hydrobiologia 595(1):195-207. 3. Brancelj, Anton. 2002. “Microdistribution and High Diversity of Copepoda (Crustacea) in a Small Cave in Central Slovenia.” Hydrobiologia 477: 59-72. 4. Brancelj, Anton. n.d. “Copepoda from a Deep-Groundwater Porous Aquifer in Contact with Karst : Description of a New Species , In the Second Half of the 20 Th Century , “Exciting Advances” Were Made in Our Knowledge of Groundwater Biodiversity (Gilbert & Culver , 2009). In E. .” 85-104. 5. Brancelj, Anton, Uroš Žibrat, and Brigita Jamnik. 2016. “Differences between Groundwater Fauna in Shallow and in Deep Intergranular Aquifers as an Indication of Different Characteristics of Habitats and Hydraulic Connections.” Journal of Limnology 75(2): 248-61. 6. Cowell, Bruce C. 1967. “The Copepoda and Cladocera of a Missouri River Reservoir: A Comparison of Sampling in the Reservoir and the Discharge.” Limnology and Oceanography 12(1):125-36. 7. Defaye, B. H. Dussart; D. 2001. Introduction to the Copepoda. Chuyên đề IV, tháng 12 năm 202040 8. Gonçalves, A. M. M., M. De Troch, S. C. Marques, M. A. Pardal, and U. M. Azeiteiro. 2010. “Spatial and Temporal Distribution of Harpacticoid Copepods in Mondego Estuary.” Journal of the Marine Biological Association of the United Kingdom 90(7):1279–90. 9. Horvath, T. G., R. L. Whitman, and L. L. Last. 2001. “Establishment of Two Invasive Crustaceans (Copepoda: Harpacticoida) in the Nearshore Sands of Lake Michigan.” Canadian Journal of Fisheries and Aquatic Sciences 58(7):1261–64. 10. Karuthapandi, M., B. Xavier Innocent, and S. Z. Siddiqi. 2012. “Zooplankton in a Temporary Freshwater Pond Habitat, in Attapur, Hyderabad Andhra Pradesh, India.” International Journal of Advanced Life Sciences (IJALS) 1:22–31. 11. L.A. Błędzki, J. I. Rybak. 2016. Freshwater Crustacean Zoophankton of Europe. 12. Liu, Wei, and Anton Brancelj. 2014. “Hydrochemical Response of Cave Drip Water to Snowmelt Water, a Case Study from Velika Pasica Cave, Central Slovenia.” Acta Carsologica 43(1):65–74. 13. Meleg, Ioana Nicoleta, Frank Fiers, Marius Robu, and Oana Teodora Moldovan. 2012. “Distribution Patterns of Subsurface Copepods and the Impact of Environmental Parameters.” Limnologica 42(2):156–64. 14. Minh, Danh. 2018. “Nghiên Cứu Thành Phần Loài và Đặc Trưng Phân Bố Của Giáp Xác Nước Ngọt (Crustacea) ở Khu Vực Vườn Quốc Gia Phong Nha - Kẻ Bàng.” 15. Mori, Nataša, and Anton Brancelj. 2008. “Distribution and Habitat Preferences of Species within the Genus Elaphoidella Chappuis, 1929 (Crustacea: Copepoda: Harpacticoida) in Slovenia.” Zoologischer Anzeiger 247(2):85–94. 16. Park G.S. and Marshall H.G. (2000) Estuarine relationships between zoo- plankton community structure and trophic gradients. Journal of Plankton Research 22, 121–135. 17. Sendacz, Suzana. 2001. “Planktonic Copepoda of the Upper Paraná River Floodplain Lakes (São Paulo and Mato Grosso Do Sul, Brazil).” Hydrobiologia 453–454:367–74. 18. Stalder L.C. and Marcus N.H. (1997) Zooplankton responses to hypoxia: behavioral patterns and survival of three species of calanoid copepods. Marine Biology 127, 599–607. 19. Streletskaya, E. A. 2010. “Review of the Fauna of Rotatoria, Cladocera, and Copepoda of the Basin of the Anadyr’ River.” Contemporary Problems of Ecology 3(4):469–80. 20. Thorp, D. Christopher Rogers; D. Christopher Rogers; James H. 2017. Keys to Nearctic Fauna Thorp and Covich ’ s Freshwater. 21. Tian, Wang, Huayong Zhang, Jian Zhang, Lei Zhao, Mingsheng Miao, and Hai Huang. 2017. “Responses of Zooplankton Community to Environmental Factors and Phytoplankton Biomass in Lake Nansihu, China.” Pakistan Journal of Zoology 49(2):493–504. 22. Tran, Duc Luong, and Anton Brancelj. 2017. “Amended Diagnosis of the Genus Nannodiaptomus (Copepoda, Calanoida), Based on Redescription of N. Phongnhaensis and Description of a New Species from Caves in Central Vietnam.” Zootaxa 4221(4):457–76. 23. Tran, Duc Luong, and Cheon Young Chang. 2012. “Two New Species of Harpacticoid Copepods from Anchialine Caves in Karst Area of North Vietnam.” Animal Cells and Systems 16(1):57–68. 24. Tran, Duc Luong, and Maria Hołyńska. 2015. “A New Mesocyclops with Archaic Morphology from a Karstic Cave in Central Vietnam, and Its Implications for the Basal Relationships within the Genus.” Annales Zoologici 65(4):661– 86. 25. Turner, Jefferson T. 2004. “The Importance of Small Planktonic Copepods and Their Roles in Pelagic Marine Food Webs.” Zoological Studies 43(2):255–66. 26. Wells. 2007. An Annotated Checklist and Keys to the Species of Copepoda Harpacticoida (Crustacea). zootaxa 1568. RESEARCH ON COMPOSITION OF COPEPODS IN VU GIA - THU BON RIVER, QUANG NAM Tran Ngoc Son, Pham THi Phuong, Trinh Đang Mau, Tran Nguyen Quynh Anh, Vo Van Minh, Dam Minh Anh, Phan THi Hoa The University of Danang - University of Science and Education ABSTRACT Copepoda plays the main role in freshwater ecosystems, is one of three major groups of freshwater zooplankton (Copepoda, Rotifera, Cladocera). The research has identified 10 species belonging to 09 genera, 6 families, 3 orders. Of these, 1 Parastenocaris genus và 2 species (Mesochra pseudoparva and Nitocra evergladensis) are firstly recorded in Vietnam for Copepoda fauna. Other findings have indicated that the density of some Copepoda species affected by environmental parameters. According to Canonical Correspondence Analysis (CCA), environmental factors including EC, TDS, NO2- và PO43- in surface water have a negative impact on the density of Schmackeria bulbosa, Thermocyclops crassus, and Mesocyclops leuckarti with coefficient -0.87, -0.24, and -0.64 respectively. Besides, in groundwater under the sand, the density of Parastenocaris sp.2 is affected by PO43- with -2.0 while EC và TDS have an influence on Mesochra pseudoparva with the same -2.15 coefficient.. Key words: Copepoda, Biodiversity, Vu Gia - Thu Bon river, Quảng Nam.
File đính kèm:
 nghien_cuu_thanh_phan_phan_lop_giap_xac_chan_cheo_copepoda_t.pdf
nghien_cuu_thanh_phan_phan_lop_giap_xac_chan_cheo_copepoda_t.pdf

