Môi trường tiết kiệm cho nuôi cấy vi tảo Dunaliella Salina quy mô pilot ở Việt Nam
Dunaliella salina là vi tảo lục đơn bào có khả năng tích lũy hàm lượng lớn carotenoid đặc
biệt β-caroten trong các điều kiện nuôi cấy bất lợi. Bốn chủng D. salina N, O, J và CCAP 19/18 được
sử dụng để khảo sát môi trường nuôi cấy MD4, RM1 và RM2 dựa trên sự tăng trưởng, hàm lượng
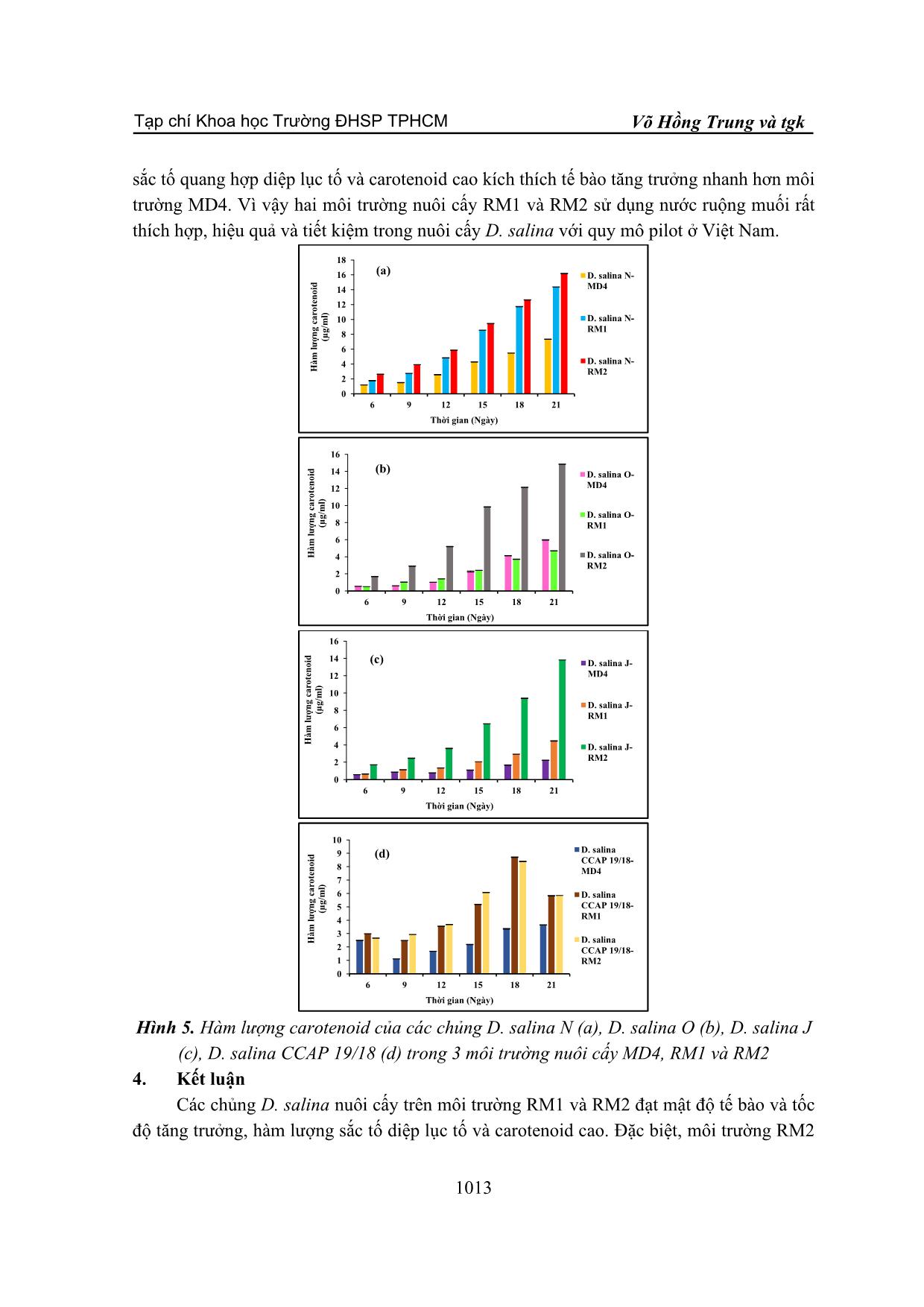
sắc tố quang hợp diệp lục tố và carotenoid. Kết quả cho thấy, mật độ tế bào và tốc độ tăng trưởng
của các chủng D. salina đạt giá trị cao khi nuôi cấy trên môi trường sử dụng nước ruộng muối RM1
và RM2. Hàm lượng diệp lục tố và carotenoid của các chủng D. salina được tổng hợp với hàm lượng
cao nhất khi được nuôi cấy trong môi trường RM2. Như vậy, môi trường RM2 kết hợp giữa nước
ruộng muối và nước biển giúp tảo tăng trưởng nhanh, ổn định và tiết kiệm phù hợp nuôi cấy D.
salina quy mô pilot ở Việt Nam.

Trang 1

Trang 2

Trang 3
Trang 4
Trang 5
Trang 6
Trang 7
Trang 8

Trang 9

Trang 10
Tóm tắt nội dung tài liệu: Môi trường tiết kiệm cho nuôi cấy vi tảo Dunaliella Salina quy mô pilot ở Việt Nam

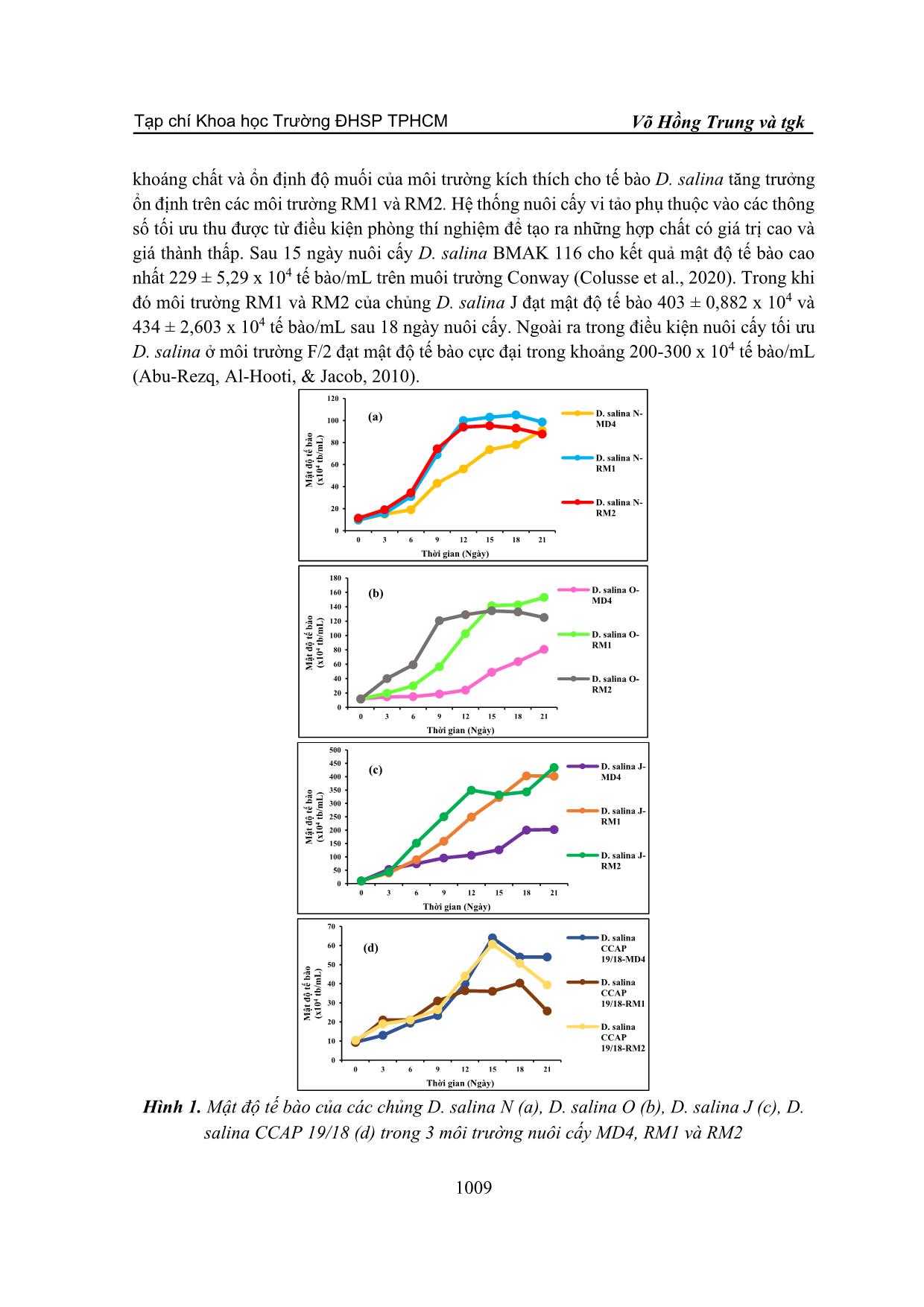
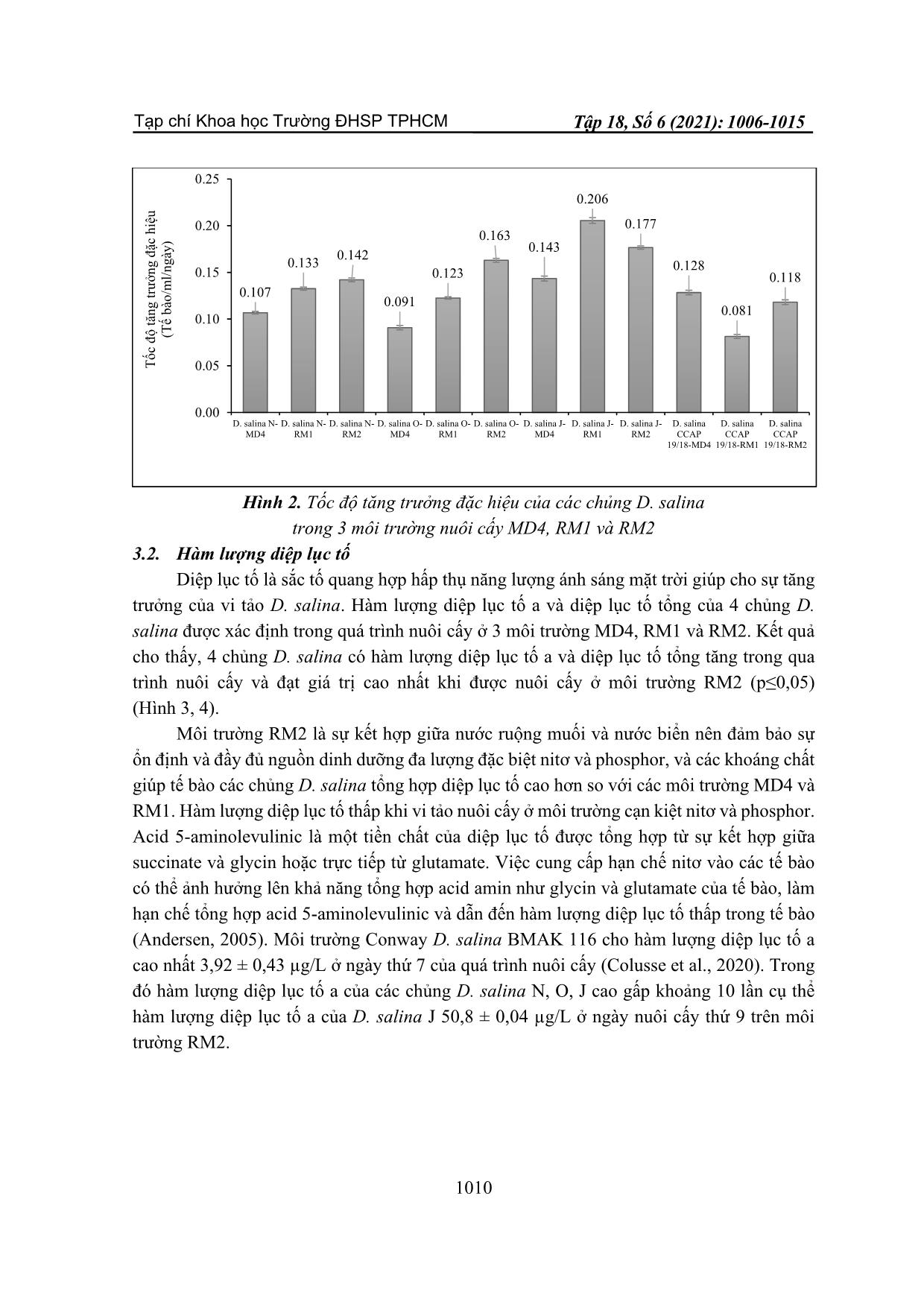
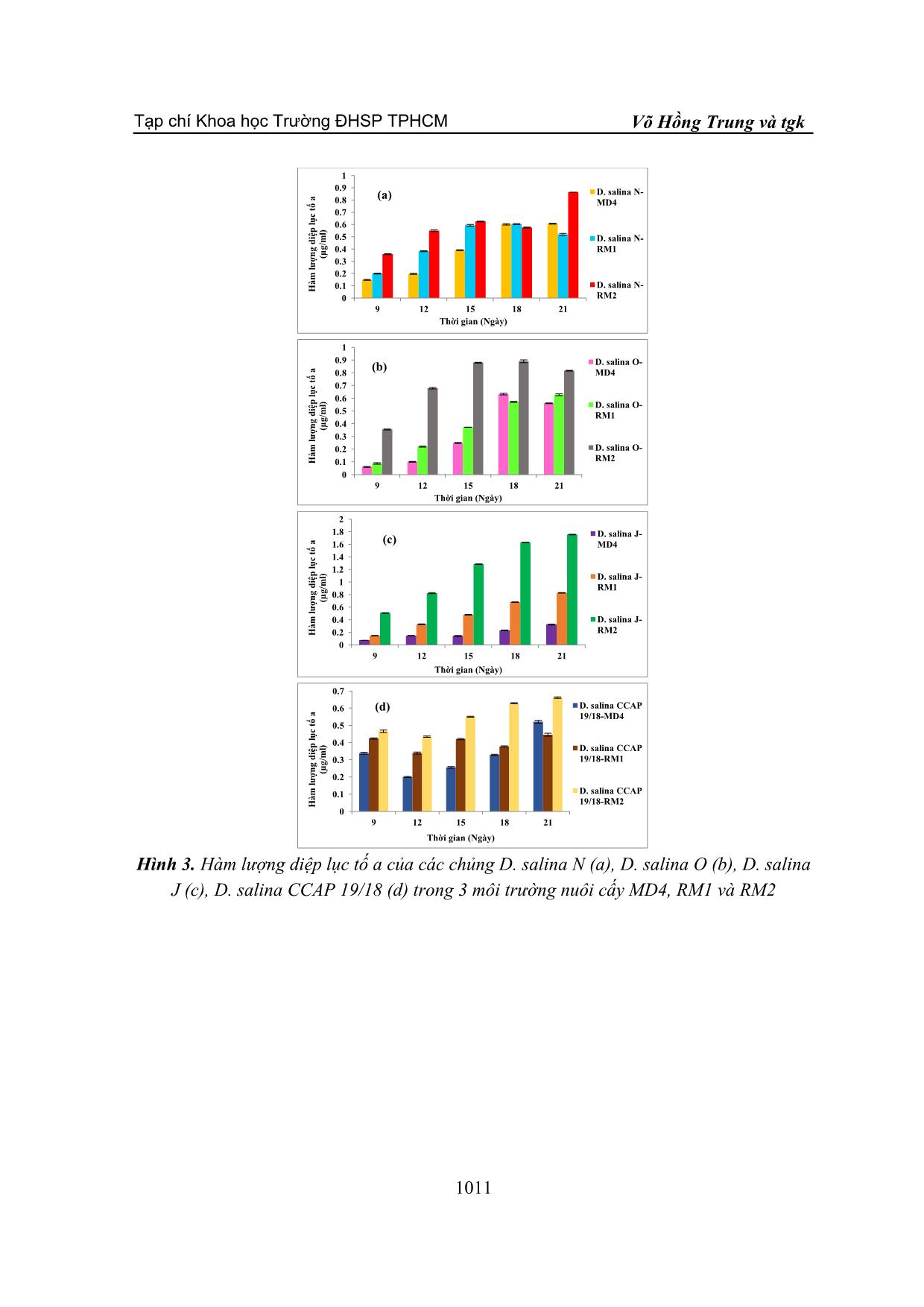
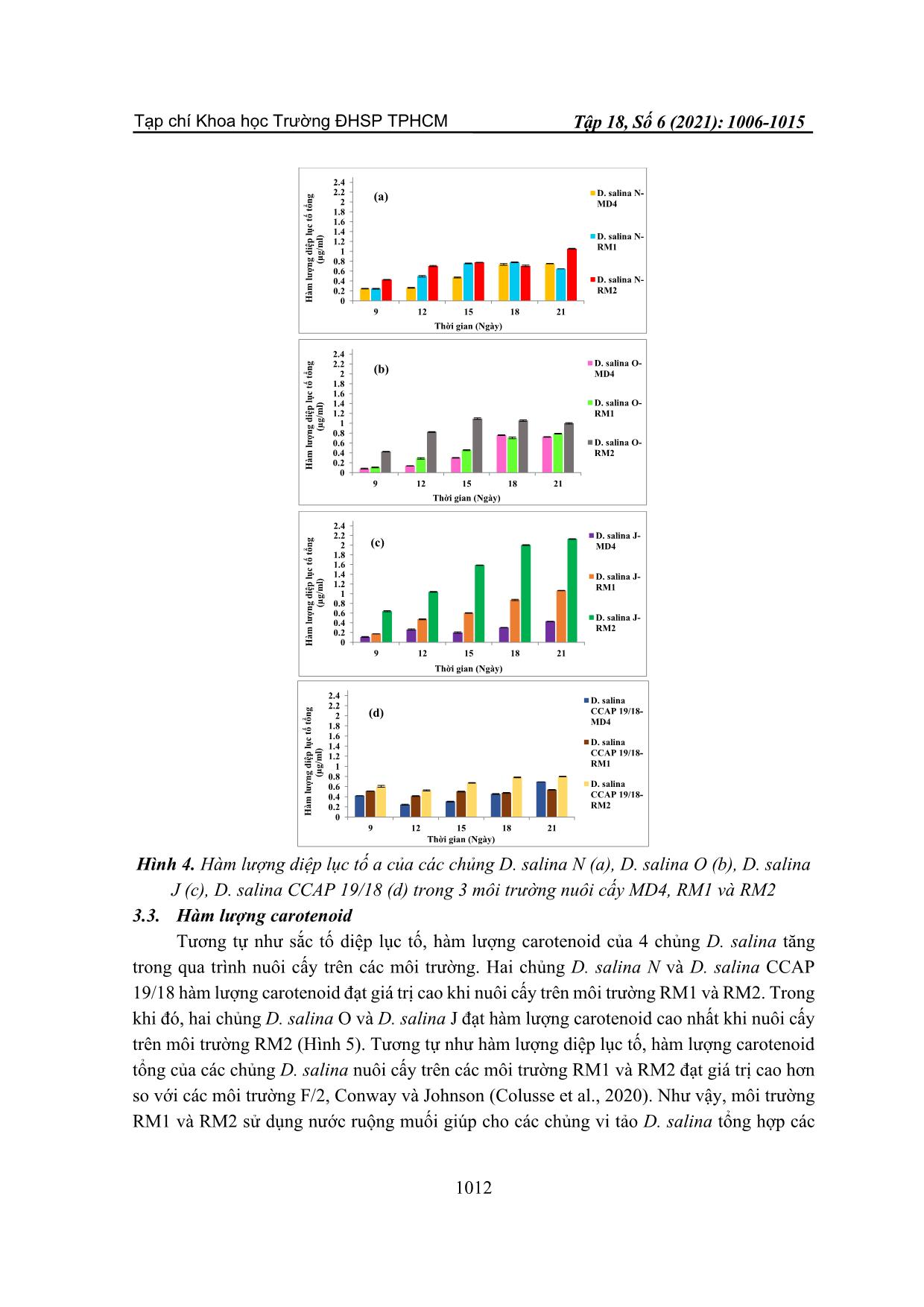
TẠP CHÍ KHOA HỌC TRƯỜNG ĐẠI HỌC SƯ PHẠM TP HỒ CHÍ MINH Tập 18, Số 6 (2021): 1006-1015 HO CHI MINH CITY UNIVERSITY OF EDUCATION JOURNAL OF SCIENCE Vol. 18, No. 6 (2021): 1006-1015 ISSN: 2734-9918 Website: 1006 Bài báo nghiên cứu* MÔI TRƯỜNG TIẾT KIỆM CHO NUÔI CẤY VI TẢO DUNALIELLA SALINA QUY MÔ PILOT Ở VIỆT NAM Võ Hồng Trung*, Nguyễn Lương Anh Tuấn, Nguyễn Thị Hồng Phúc Trường Đại học Nguyễn Tất Thành, Việt Nam *Tác giả liên hệ: Võ Hồng Trung – Email: vohongtrung2503@gmail.com Ngày nhận bài: 14-01-2021; ngày nhận bài sửa: 24-5-2021; ngày duyệt đăng: 10-6-2021 TÓM TẮT Dunaliella salina là vi tảo lục đơn bào có khả năng tích lũy hàm lượng lớn carotenoid đặc biệt β-caroten trong các điều kiện nuôi cấy bất lợi. Bốn chủng D. salina N, O, J và CCAP 19/18 được sử dụng để khảo sát môi trường nuôi cấy MD4, RM1 và RM2 dựa trên sự tăng trưởng, hàm lượng sắc tố quang hợp diệp lục tố và carotenoid. Kết quả cho thấy, mật độ tế bào và tốc độ tăng trưởng của các chủng D. salina đạt giá trị cao khi nuôi cấy trên môi trường sử dụng nước ruộng muối RM1 và RM2. Hàm lượng diệp lục tố và carotenoid của các chủng D. salina được tổng hợp với hàm lượng cao nhất khi được nuôi cấy trong môi trường RM2. Như vậy, môi trường RM2 kết hợp giữa nước ruộng muối và nước biển giúp tảo tăng trưởng nhanh, ổn định và tiết kiệm phù hợp nuôi cấy D. salina quy mô pilot ở Việt Nam. Từ khóa: Carotenoid; diệp lục tố; Dunaliella salina; nuôi cấy pilot 1. Giới thiệu Dunaliella salina là một loại tảo lục đơn bào thuộc họ Chlorophyceae, được biết với khả năng tích lũy hàm lượng lớn carotenoid trong các điều kiện nuôi cấy ức chế. Tảo này có thể mang lại ba sản phẩm có giá trị lớn là glycerol, β-carotene và protein cao (Murthy et al., 2005). Carotenoid là nhóm sắc tố có khả năng chống oxy hóa, giúp ngăn ngừa hoặc trì hoãn các bệnh mãn tính như ung thư, lão hóa, xơ cứng động mạch, đục thủy tinh thể. Trên thế giới, mô hình làm giàu β-caroten trong sinh khối của D. salina đã được nghiên cứu trên quy mô phòng thí nghiệm và sản xuất thương mại (Ben-Amotz, 1987). Trong nuôi cấy D. salina, độ mặn tối ưu cho sự phát triển nằm trong khoảng 18-22% NaCl, trong khi độ mặn tối ưu để sản xuất carotenoid là > 27% NaCl (Borowitzka, Moulton, & Borowitzka, 1984). Một số chủng Dunaliella có thể tích lũy β-carotene và glycerol, những đặc tính có lợi ích về kinh tế đã dẫn đến việc nuôi quy mô lớn loại tảo này ở một số quốc gia như Úc, Trung Quốc, Israel và Ấn Độ với các dự án quy mô thử nghiệm ở các nước khác (Chile, Tây Ban Nha, Iran) (Sathasivam, & Juntawong, 2013). Hầu hết các nghiên cứu Cite this article as: Vo Hong Trung, Nguyen Luong Anh Tuan, & Nguyen Thi Hong Phuc (2021). Saving media for pilot – scale cultivation of Dunaliella salina microalga in Viet Nam. Ho Chi Minh City University of Education Journal of Science, 18(6), 1006-1015. Tạp chí Khoa học Trường ĐHSP TPHCM Võ Hồng Trung và tgk 1007 D. salina được thực hiện trên các môi trường nước biển nhân tạo hoặc môi trường nước biển bổ sung dinh dưỡng. Trong nuôi cấy D. salina với quy mô pilot để thu nhận sinh khối có hàm lượng β-carotene cao thì môi trường nuôi cấy hiệu quả và giá thành thấp là yếu tố rất quan trọng. Việt Nam là nước nhiệt đới có tiềm năng biển rất lớn với bờ biển dài hơn 3200 km và các vùng ruộng muối nổi tiếng như Sa Huỳnh, Đề Gi, Ninh Diêm, Cam Ranh, Long Điền, Cần Giờ. Việc tận dụng nguồn nước biển và ruộng muối phục vụ cho nuôi cấy D. salina vô cùng hữu ích. Môi trường MD4 1,5M NaCl do Tran và cộng sự (2013) xây dựng phải sử dụng nguồn muối (NaCl) (Tran et al., 2013) nên ảnh hưởng đến chi phí và hiệu quả khi thực hiện nuôi cấy D. salina ở quy mô pilot. Vì vậy, nghiên cứu này nhằm xây dựng môi trường sử dụng nguồn nước ruộng muối và nước biển để đạt hiệu quả sinh khối và tiết kiệm chi phí trong nuôi cấy D. salina ở Việt Nam. 2. Vật liệu và phương pháp 2.1. Chủng Dunaliella salina Thí nghiệm thực hiện trên 3 chủng D. salina: Dunaliella salina CCAP 19/18 được cung cấp bởi Juergen E. W. Polle – Phòng Sinh học, Trường Đại học Brooklyn, New York, Hoa Kì. Dunaliella salina J, N phân lập ở Khánh Hòa, Việt Nam. Dunaliella salina O phân lập ở Vĩnh Hảo, Bình Thuận, Việt Nam 2.2. Thiết kế thí nghiệm Các chủng D. salina được nuôi cấy trong môi trường MD4 1,5 M NaCl, sục khí liên tục và chiếu sáng ở cường độ 100 µmol photon/m2/s, chu kì sáng: tối = 12:12h. Sau 10 ngày nuôi cấy, tảo đạt pha tăng trưởng được sử dụng để bố trí thí nghiệm. Nước ruộng muối sử dụng cho thí nghiệm được thu tại vùng ruộng muối Cần Thạnh, Cần Giờ, Thành phố Hồ Chí Minh vào thời điểm khoảng từ tháng 12 đến tháng 2, độ muối cao khoảng 380‰. Nước biển được thu tại vùng biển Lagi, Bình Thuận tháng 12 hàng năm. Các chủng D. salina được nuôi cấy trên 3 môi trường: Môi trường MD4 1,5M NaCl theo Tran và cộng sự (2013) (Tran et al., 2013). Môi trường RM1: nước ruộng muối pha loãng với nước cất để ... m 1 và 2 2.5. Xác định hàm lượng sắc tố Lấy 1 mL dịch nuôi cấy, li tâm ở 13.000 vòng trong 5 phút, phần tảo bên dưới được li trích với 3 mL ethanol: hexane (2:1 v/v), trộn đều. Thêm vào 4 mL hexane, trộn đều. Hỗn hợp li trích này được li tâm 3.000 vòng trong 5 phút. Lớp sắc tố có hexane bên trên được đo ở các bước sóng 450 nm, 662 nm và 645 nm. Hàm lượng carotenoid tổng được xác định theo công thức: Carotenoid (µg/mL) = A450 x 25,2 (Prieto, Canavate, & García-González, 2011). Hàm lượng diệp lục tố a và diệp lục tố tổng được xác định theo (Lichtenthaler & Wellburn, 1983). Diệp lục tố a (µg/mL) = 11,75 (A662) – 2,35 (A645) Diệp lục tố b (µg/mL) = 18,61 (A645) – 3,96 (A662) Diệp lục tố tổng (µg/mL) = diệp lục tố a + diệp lục tố b trong đó: A645: độ hấp thụ ở bước sóng 645 nm A662: độ hấp thu ở bước sóng 662 nm 2.6. Xử lí số liệu Các thí nghiệm được lặp lại 3 lần. Số liệu được xử lí bằng Microsoft office Excel 2019 và phân tích one-way ANOVAbằng phần mềm SPSS 20.0 với sai số ý nghĩa p≤0,05. 3. Kết quả và thảo luận 3.1. Sự tăng trưởng của D. salina Hình 1 thể hiện sự tăng trưởng của các chủng D. salina nuôi cấy trong 3 môi trường MD4, RM1 và RM2. Mật độ tế bào của 4 chủng D. salina đạt cực đại sau 12 ngày nuôi cấy ở cả 3 môi trường. Ba chủng D. salina N, O, J mật độ tế bào và tốc độ tăng trưởng đạt giá trị cao hơn khi nuôi cấy ở môi trường RM1 và RM2 so với môi trường MD4 (p≤0,05). Trong khi đó, mật độ tế bào và tốc độ tăng trưởng của D. salina CCAP 19/18 nuôi cấy trong môi trường MD4 và RM2 cao hơn môi trường RM1 (p≤0,05) (Hình 2). Nước ruộng muối có các thành phần dinh dưỡng quan trọng giúp bổ sung vào môi trường nuôi cấy. Ngoài ra, độ muối cao có vai trò điều hoà áp suất thẩm thấu và ion trong tế bào, duy trì sự sống ổn định cho tế vi tảo D. salina. Bên cạnh đó, nước biển là môi trường thích hợp nhất để nuôi cấy vi tảo vì có sẵn một nguồn dinh dưỡng vô cơ dồi dào, đa phần là các hợp chất của nitrate, phosphor và các nguyên tố vi lượng có vai trò quan trọng trong sự tăng trưởng của các tế bào (Atkinson, 1997). Sự kết hợp giữa nước ruộng muối và nước biển giúp duy trình nguồn dinh dưỡng, Tạp chí Khoa học Trường ĐHSP TPHCM Võ Hồng Trung và tgk 1009 khoáng chất và ổn định độ muối của môi trường kích thích cho tế bào D. salina tăng trưởng ổn định trên các môi trường RM1 và RM2. Hệ thống nuôi cấy vi tảo phụ thuộc vào các thông số tối ưu thu được từ điều kiện phòng thí nghiệm để tạo ra những hợp chất có giá trị cao và giá thành thấp. Sau 15 ngày nuôi cấy D. salina BMAK 116 cho kết quả mật độ tế bào cao nhất 229 ± 5,29 x 104 tế bào/mL trên muôi trường Conway (Colusse et al., 2020). Trong khi đó môi trường RM1 và RM2 của chủng D. salina J đạt mật độ tế bào 403 ± 0,882 x 104 và 434 ± 2,603 x 104 tế bào/mL sau 18 ngày nuôi cấy. Ngoài ra trong điều kiện nuôi cấy tối ưu D. salina ở môi trường F/2 đạt mật độ tế bào cực đại trong khoảng 200-300 x 104 tế bào/mL (Abu-Rezq, Al-Hooti, & Jacob, 2010). Hình 1. Mật độ tế bào của các chủng D. salina N (a), D. salina O (b), D. salina J (c), D. salina CCAP 19/18 (d) trong 3 môi trường nuôi cấy MD4, RM1 và RM2 0 20 40 60 80 100 120 0 3 6 9 12 15 18 21 M ậ t đ ộ t ế b à o (x 1 0 4 tb /m L ) Thời gian (Ngày) D. salina N- MD4 D. salina N- RM1 D. salina N- RM2 (a) 0 20 40 60 80 100 120 140 160 180 0 3 6 9 12 15 18 21 M ậ t đ ộ t ế b à o (x 1 0 4 tb /m L ) Thời gian (Ngày) D. salina O- MD4 D. salina O- RM1 D. salina O- RM2 (b) 0 50 100 150 200 250 300 350 400 450 500 0 3 6 9 12 15 18 21 M ậ t đ ộ t ế b à o (x 1 0 4 tb /m L ) Thời gian (Ngày) D. salina J- MD4 D. salina J- RM1 D. salina J- RM2 (c) 0 10 20 30 40 50 60 70 0 3 6 9 12 15 18 21 M ậ t đ ộ t ế b à o (x 1 0 4 tb /m L ) Thời gian (Ngày) D. salina CCAP 19/18-MD4 D. salina CCAP 19/18-RM1 D. salina CCAP 19/18-RM2 (d) Tạp chí Khoa học Trường ĐHSP TPHCM Tập 18, Số 6 (2021): 1006-1015 1010 Hình 2. Tốc độ tăng trưởng đặc hiệu của các chủng D. salina trong 3 môi trường nuôi cấy MD4, RM1 và RM2 3.2. Hàm lượng diệp lục tố Diệp lục tố là sắc tố quang hợp hấp thụ năng lượng ánh sáng mặt trời giúp cho sự tăng trưởng của vi tảo D. salina. Hàm lượng diệp lục tố a và diệp lục tố tổng của 4 chủng D. salina được xác định trong quá trình nuôi cấy ở 3 môi trường MD4, RM1 và RM2. Kết quả cho thấy, 4 chủng D. salina có hàm lượng diệp lục tố a và diệp lục tố tổng tăng trong qua trình nuôi cấy và đạt giá trị cao nhất khi được nuôi cấy ở môi trường RM2 (p≤0,05) (Hình 3, 4). Môi trường RM2 là sự kết hợp giữa nước ruộng muối và nước biển nên đảm bảo sự ổn định và đầy đủ nguồn dinh dưỡng đa lượng đặc biệt nitơ và phosphor, và các khoáng chất giúp tế bào các chủng D. salina tổng hợp diệp lục tố cao hơn so với các môi trường MD4 và RM1. Hàm lượng diệp lục tố thấp khi vi tảo nuôi cấy ở môi trường cạn kiệt nitơ và phosphor. Acid 5-aminolevulinic là một tiền chất của diệp lục tố được tổng hợp từ sự kết hợp giữa succinate và glycin hoặc trực tiếp từ glutamate. Việc cung cấp hạn chế nitơ vào các tế bào có thể ảnh hưởng lên khả năng tổng hợp acid amin như glycin và glutamate của tế bào, làm hạn chế tổng hợp acid 5-aminolevulinic và dẫn đến hàm lượng diệp lục tố thấp trong tế bào (Andersen, 2005). Môi trường Conway D. salina BMAK 116 cho hàm lượng diệp lục tố a cao nhất 3,92 ± 0,43 µg/L ở ngày thứ 7 của quá trình nuôi cấy (Colusse et al., 2020). Trong đó hàm lượng diệp lục tố a của các chủng D. salina N, O, J cao gấp khoảng 10 lần cụ thể hàm lượng diệp lục tố a của D. salina J 50,8 ± 0,04 µg/L ở ngày nuôi cấy thứ 9 trên môi trường RM2. 0.107 0.133 0.142 0.091 0.123 0.163 0.143 0.206 0.177 0.128 0.081 0.118 0.00 0.05 0.10 0.15 0.20 0.25 D. salina N- MD4 D. salina N- RM1 D. salina N- RM2 D. salina O- MD4 D. salina O- RM1 D. salina O- RM2 D. salina J- MD4 D. salina J- RM1 D. salina J- RM2 D. salina CCAP 19/18-MD4 D. salina CCAP 19/18-RM1 D. salina CCAP 19/18-RM2 T ố c đ ộ t ăn g t rư ở n g đ ặc h iệ u (T ế b ào /m l/ n g ày ) Tạp chí Khoa học Trường ĐHSP TPHCM Võ Hồng Trung và tgk 1011 Hình 3. Hàm lượng diệp lục tố a của các chủng D. salina N (a), D. salina O (b), D. salina J (c), D. salina CCAP 19/18 (d) trong 3 môi trường nuôi cấy MD4, RM1 và RM2 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1 9 12 15 18 21 H à m l ư ợ n g d iệ p l ụ c tố a (µ g /m l) Thời gian (Ngày) D. salina N- MD4 D. salina N- RM1 D. salina N- RM2 (a) 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1 9 12 15 18 21 H à m l ư ợ n g d iệ p l ụ c tố a (µ g /m l) Thời gian (Ngày) D. salina O- MD4 D. salina O- RM1 D. salina O- RM2 (b) 0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6 1.8 2 9 12 15 18 21 H à m l ư ợ n g d iệ p l ụ c tố a (µ g /m l) Thời gian (Ngày) D. salina J- MD4 D. salina J- RM1 D. salina J- RM2 (c) 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 9 12 15 18 21 H à m l ư ợ n g d iệ p l ụ c tố a (µ g /m l) Thời gian (Ngày) D. salina CCAP 19/18-MD4 D. salina CCAP 19/18-RM1 D. salina CCAP 19/18-RM2 (d) Tạp chí Khoa học Trường ĐHSP TPHCM Tập 18, Số 6 (2021): 1006-1015 1012 Hình 4. Hàm lượng diệp lục tố a của các chủng D. salina N (a), D. salina O (b), D. salina J (c), D. salina CCAP 19/18 (d) trong 3 môi trường nuôi cấy MD4, RM1 và RM2 3.3. Hàm lượng carotenoid Tương tự như sắc tố diệp lục tố, hàm lượng carotenoid của 4 chủng D. salina tăng trong qua trình nuôi cấy trên các môi trường. Hai chủng D. salina N và D. salina CCAP 19/18 hàm lượng carotenoid đạt giá trị cao khi nuôi cấy trên môi trường RM1 và RM2. Trong khi đó, hai chủng D. salina O và D. salina J đạt hàm lượng carotenoid cao nhất khi nuôi cấy trên môi trường RM2 (Hình 5). Tương tự như hàm lượng diệp lục tố, hàm lượng carotenoid tổng của các chủng D. salina nuôi cấy trên các môi trường RM1 và RM2 đạt giá trị cao hơn so với các môi trường F/2, Conway và Johnson (Colusse et al., 2020). Như vậy, môi trường RM1 và RM2 sử dụng nước ruộng muối giúp cho các chủng vi tảo D. salina tổng hợp các 0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6 1.8 2 2.2 2.4 9 12 15 18 21 H à m l ư ợ n g d iệ p l ụ c tố t ổ n g (µ g /m l) Thời gian (Ngày) D. salina N- MD4 D. salina N- RM1 D. salina N- RM2 (a) 0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6 1.8 2 2.2 2.4 9 12 15 18 21 H à m l ư ợ n g d iệ p l ụ c tố t ổ n g (µ g /m l) Thời gian (Ngày) D. salina O- MD4 D. salina O- RM1 D. salina O- RM2 (b) 0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6 1.8 2 2.2 2.4 9 12 15 18 21 H à m l ư ợ n g d iệ p l ụ c tố t ổ n g (µ g /m l) Thời gian (Ngày) D. salina J- MD4 D. salina J- RM1 D. salina J- RM2 (c) 0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6 1.8 2 2.2 2.4 9 12 15 18 21 H à m l ư ợ n g d iệ p l ụ c tố t ổ n g (µ g /m l) Thời gian (Ngày) D. salina CCAP 19/18- MD4 D. salina CCAP 19/18- RM1 D. salina CCAP 19/18- RM2 (d) Tạp chí Khoa học Trường ĐHSP TPHCM Võ Hồng Trung và tgk 1013 sắc tố quang hợp diệp lục tố và carotenoid cao kích thích tế bào tăng trưởng nhanh hơn môi trường MD4. Vì vậy hai môi trường nuôi cấy RM1 và RM2 sử dụng nước ruộng muối rất thích hợp, hiệu quả và tiết kiệm trong nuôi cấy D. salina với quy mô pilot ở Việt Nam. Hình 5. Hàm lượng carotenoid của các chủng D. salina N (a), D. salina O (b), D. salina J (c), D. salina CCAP 19/18 (d) trong 3 môi trường nuôi cấy MD4, RM1 và RM2 4. Kết luận Các chủng D. salina nuôi cấy trên môi trường RM1 và RM2 đạt mật độ tế bào và tốc độ tăng trưởng, hàm lượng sắc tố diệp lục tố và carotenoid cao. Đặc biệt, môi trường RM2 0 2 4 6 8 10 12 14 16 18 6 9 12 15 18 21 H à m l ư ợ n g c a ro te n o id (µ g /m l) Thời gian (Ngày) D. salina N- MD4 D. salina N- RM1 D. salina N- RM2 (a) 0 2 4 6 8 10 12 14 16 6 9 12 15 18 21 H à m l ư ợ n g c a ro te n o id (µ g /m l) Thời gian (Ngày) D. salina O- MD4 D. salina O- RM1 D. salina O- RM2 (b) 0 2 4 6 8 10 12 14 16 6 9 12 15 18 21 H à m l ư ợ n g c a ro te n o id (µ g /m l) Thời gian (Ngày) D. salina J- MD4 D. salina J- RM1 D. salina J- RM2 (c) 0 1 2 3 4 5 6 7 8 9 10 6 9 12 15 18 21 H à m l ư ợ n g c a ro te n o id (µ g /m l) Thời gian (Ngày) D. salina CCAP 19/18- MD4 D. salina CCAP 19/18- RM1 D. salina CCAP 19/18- RM2 (d) Tạp chí Khoa học Trường ĐHSP TPHCM Tập 18, Số 6 (2021): 1006-1015 1014 sử dụng nước ruộng muối và nước biển có độ muối và nguồn dinh dưỡng phù hợp và ổn định giúp tế bào D. salina đạt các chỉ số tăng trưởng cao và ổn định, kích thích sinh tổng hợp sắc tố quang hợp diệp lục tố và carotenoid, hơn so với môi trường MD4 và RM1. Vì vậy, môi trường RM2 phù hợp, hiệu quả và tiết kiệm cho nuôi cấy vi tảo D. salina trên quy mô pilot ở Việt Nam. ❖ Tuyên bố về quyền lợi: Các tác giả xác nhận hoàn toàn không có xung đột về quyền lợi. TÀI LIỆU THAM KHẢO Abu-Rezq, T. S., Al-Hooti, S., & Jacob, D. A. (2010). Optimum culture conditions required for the locally isolated Dunaliella salina. J. Algal Biomass Utln, 1(2), 12-19. Andersen, R. A. (2005). Algal Culturing Techniques: Academic Press. Atkinson, M. J., and C. Bingman. (1997). Elemental composition of commercial seasalts. Journal of Aquariculture and Aquatic Sciences, 8(2), 39-43. Ben-Amotz, A. (1987). Effect of irradiance and nutrient deficiency on the chemical composition of Dunaliella bardawil Ben-Amotz and Avron (Volvocales, Chlorophyta). Journal of plant physiology, 131(5), 479-487. Borowitzka, L., Moulton, T., & Borowitzka, M. (1984). The mass culture of Dunaliella salina for fine chemicals: from laboratory to pilot plant. Paper presented at the Eleventh International Seaweed Symposium. Colusse, G. A., Mendes, C. R. B., Duarte, M. E. R., de Carvalho, J. C., & Noseda, M. D. (2020). Effects of different culture media on physiological features and laboratory scale production cost of Dunaliella salina. Biotechnology Reports, 27, e00508. Levasseur, M., Peter A. Thompson, and Paul J. Harrison. (1993). Physiological acclimation of marine phytoplankton to different nitrogen sources 1. Journal of Phycology, 29(5), 587-595. Lichtenthaler, H. K., & Wellburn, A. R. (1983). Determinations of total carotenoids and chlorophylls a and b of leaf extracts in different solvents. In: Portland Press Ltd. Murthy, K. C., Vanitha, A., Rajesha, J., Swamy, M. M., Sowmya, P., & Ravishankar, G. A. (2005). In vivo antioxidant activity of carotenoids from Dunaliella salina—a green microalga. Life sciences, 76(12), 1381-1390. Prieto, A., Canavate, J. P., & García-González, M. (2011). Assessment of carotenoid production by Dunaliella salina in different culture systems and operation regimes. Journal of biotechnology, 151(2), 180-185. Robert, A. a. (2005). Algal culturing techniques: Elsevier. Sathasivam, R., & Juntawong, N. (2013). Modified medium for enhanced growth of Dunaliella strains. Int J Curr Sci, 5, 67-73. Tran, D. N., Doan, N. N. T., Ho, K. Q. M., Nguyen, T. M. L., Sixto, P., Hoang, T., & Duong, D. T. (2013). A potential low cost medium for cultivation of Dunaliella salina DCCBC15 in Vietnam. Journal of Biology, 35(3), 328-332. Tạp chí Khoa học Trường ĐHSP TPHCM Võ Hồng Trung và tgk 1015 SAVING MEDIA FOR PILOT – SCALE CULTIVATION OF DUNALIELLA SALINA MICROALGA IN VIET NAM Vo Hong Trung*, Nguyen Luong Anh Tuan, Nguyen Thi Hong Phuc Nguyen Tat Thanh Univesity, Vietnam *Corresponding author: Vo Hong Trung – Email: vohongtrung2503@gmail.com Received: January 14, 2021; Revised: May 24, 2021; Accepted: June 10, 2021 ABSTRACT Dunaliella salina is a unicellular green microalgae capable of accumulating large carotenoid contents, in particular β-carotene under adverse culturing conditions. Four strains of D. salina N, O, J and CCAP 19/18 were used to investigate MD4, RM1, and RM2 media based on the cell density, growth rate, photosynthesis pigments chlorophyll, and carotenoid. The results showed that the cell density and growth rate of D. salina strains were high when cultured in RM1 and RM2 media using salt field water. The chlorophyll and carotenoid of D. salina strains were synthesized with the highest contents when cultured in an RM2 medium. Thus, the RM2 medium combining with salt field water and seawater stimulated D. salina cells to grow rapidly, stably, and economically, suitable for D. salina pilot-scale culture in Viet Nam. Keywords: carotenoid; chlorophyll; Dunaliella salina; pilot-scale
File đính kèm:
 moi_truong_tiet_kiem_cho_nuoi_cay_vi_tao_dunaliella_salina_q.pdf
moi_truong_tiet_kiem_cho_nuoi_cay_vi_tao_dunaliella_salina_q.pdf

