Cơ chế gây độc Arsen và khả năng giải độc Arsen của vi sinh vật
Khi tế bào sinh vật chịu tác động bởi arsen thì màng tế bào là vị trí đầu tiên bị tác động.
Nếu arsen ở nồng độ cao sẽ dẫn đến sự phá hủy của màng làm cho tế bào chết (Tuấn và cs, 2008).
Tuy nhiên, ở nồng độ thấp màng tế bào có thể bảo vệ tế bào bởi tác động của độc chất và hấp thu
một lượng lớn arsen từ môi trường lây nhiễm. Sự hấp thu arsen chịu ảnh hưởng bởi một số yếu tố
như ánh sáng, nhiệt độ, pH và cả nồng đọ arsen. Kết quả nghiên cứu này cho thấy tế bào và màng
tế bào có khả năng hấp thu độc chất dưới ảnh hưởng của ánh sáng. Tuy nhiên, ánh sáng đã tăng
cường sự loại thải arsen ra khỏi tế bào qua hoạt động của màng. Kết quả nghiên cứu này có thể
ứng dụng cho việc loại thải arsen ra khỏi môi trường nước bằng thực vật thủy sinh. Ảnh hưởng
độc của arsen lên màng cũng được nghiên cứu sự tương tác giữa arsen và màng tế bào nhân tạo.
Kết quả nghiên cứu cho thấy arsen có thể tấn công ngay trên cấu trúc màng lipid là cho lớp màng
này thay đổi về tính chất dẫn đến sự chết (nồng độ cao của arsen) hoặc thích ứng và tồn tại (nồng
độ thấp của arsen) để bảo vệ tế bào.

Trang 1

Trang 2

Trang 3

Trang 4

Trang 5
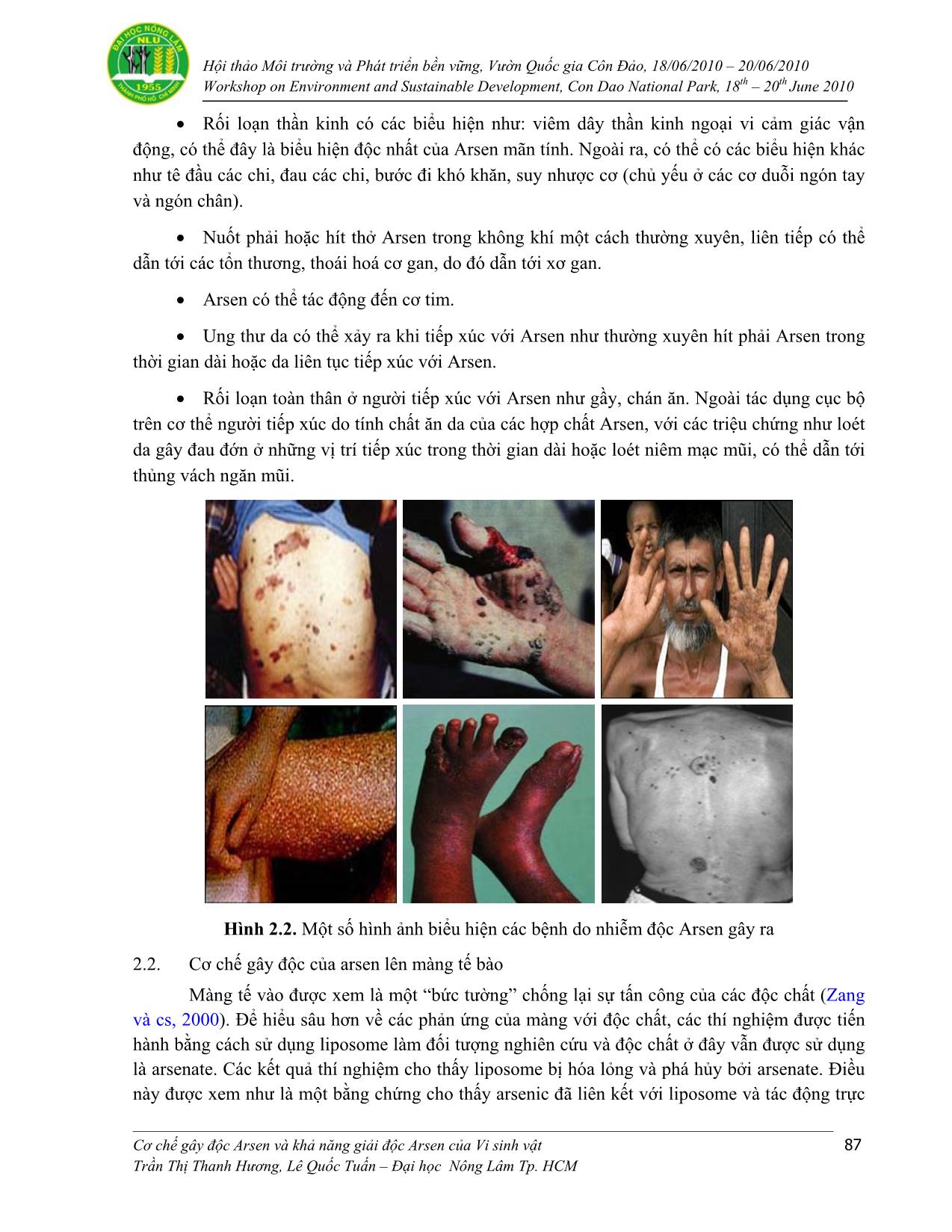
Trang 6

Trang 7

Trang 8
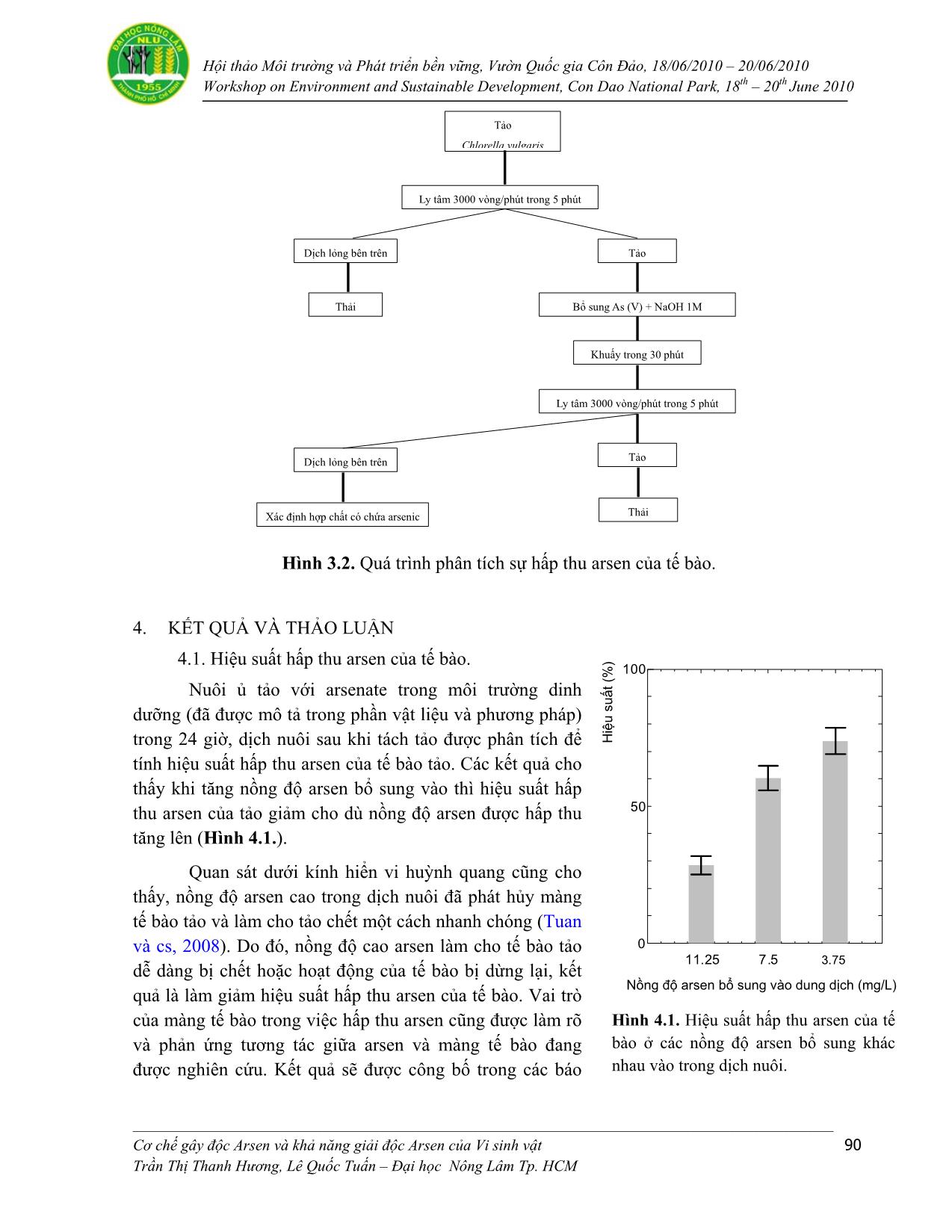
Trang 9
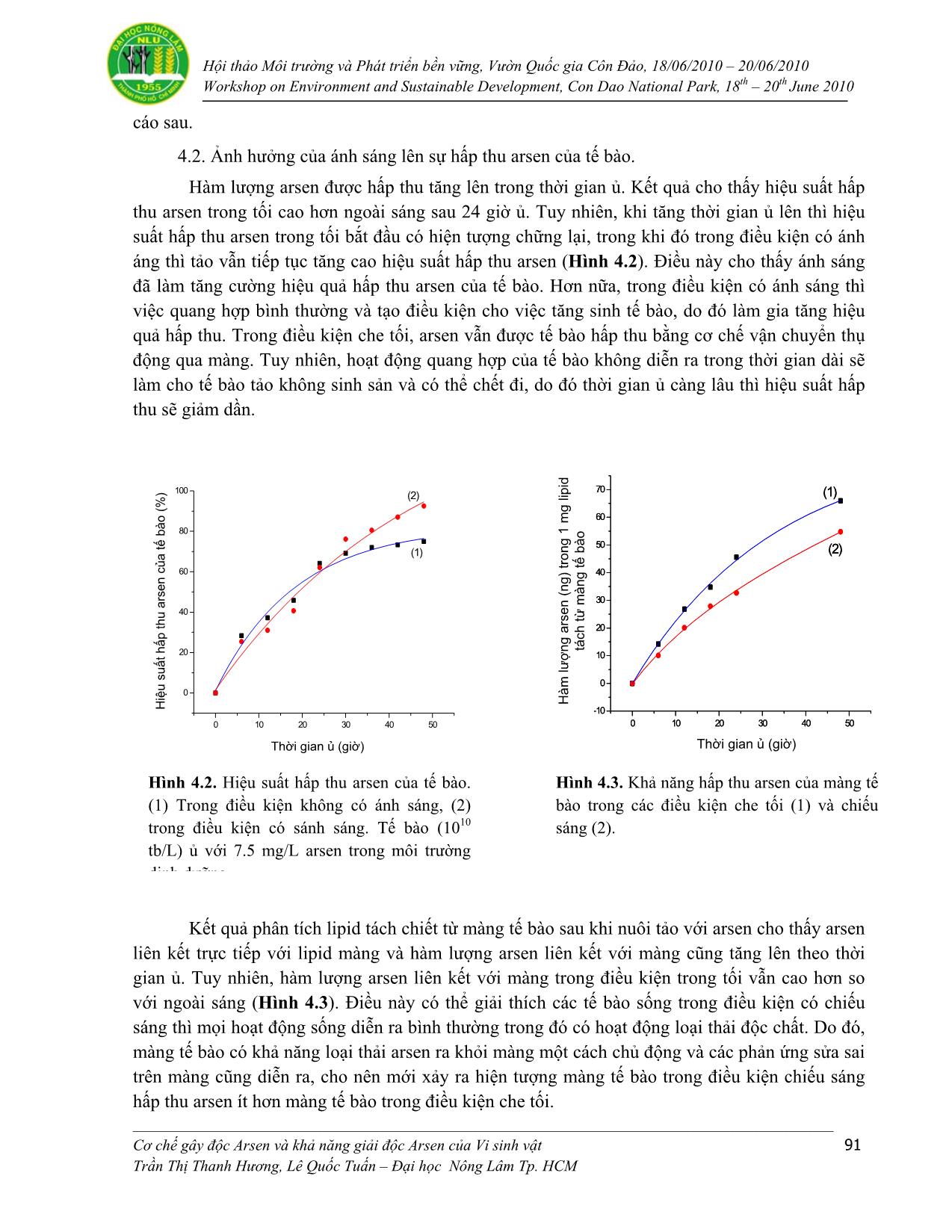
Trang 10
Tải về để xem bản đầy đủ
Tóm tắt nội dung tài liệu: Cơ chế gây độc Arsen và khả năng giải độc Arsen của vi sinh vật

Hội thảo Môi trường và Phát triển bền vững, Vườn Quốc gia Côn Đảo, 18/06/2010 – 20/06/2010 Workshop on Environment and Sustainable Development, Con Dao National Park, 18th – 20th June 2010 __________________________________________________________________________________________ Cơ chế gây độc Arsen và khả năng giải độc Arsen của Vi sinh vật 82 Trần Thị Thanh Hương, Lê Quốc Tuấn – Đại học Nông Lâm Tp. HCM CƠ CHẾ GÂY ĐỘC ARSEN VÀ KHẢ NĂNG GIẢI ĐỘC ARSEN CỦA VI SINH VẬT Trần Thị Thanh Hương1, Lê Quốc Tuấn2 1Khoa Khoa Học, 2Khoa Môi trường và Tài nguyên Trường Đại học Nông Lâm TP. Hồ Chí Minh Email: huongtran@hcmuaf.edu.vn TÓM TẮT Khi tế bào sinh vật chịu tác động bởi arsen thì màng tế bào là vị trí đầu tiên bị tác động. Nếu arsen ở nồng độ cao sẽ dẫn đến sự phá hủy của màng làm cho tế bào chết (Tuấn và cs, 2008). Tuy nhiên, ở nồng độ thấp màng tế bào có thể bảo vệ tế bào bởi tác động của độc chất và hấp thu một lượng lớn arsen từ môi trường lây nhiễm. Sự hấp thu arsen chịu ảnh hưởng bởi một số yếu tố như ánh sáng, nhiệt độ, pH và cả nồng đọ arsen. Kết quả nghiên cứu này cho thấy tế bào và màng tế bào có khả năng hấp thu độc chất dưới ảnh hưởng của ánh sáng. Tuy nhiên, ánh sáng đã tăng cường sự loại thải arsen ra khỏi tế bào qua hoạt động của màng. Kết quả nghiên cứu này có thể ứng dụng cho việc loại thải arsen ra khỏi môi trường nước bằng thực vật thủy sinh. Ảnh hưởng độc của arsen lên màng cũng được nghiên cứu sự tương tác giữa arsen và màng tế bào nhân tạo. Kết quả nghiên cứu cho thấy arsen có thể tấn công ngay trên cấu trúc màng lipid là cho lớp màng này thay đổi về tính chất dẫn đến sự chết (nồng độ cao của arsen) hoặc thích ứng và tồn tại (nồng độ thấp của arsen) để bảo vệ tế bào. SUMMARY Cell under arsenic condition, the cell membrane was initially affected. With arsenic at high concentration, cell and cell membrane was damaged subsequently leading to cell death (Tuan et al., 2008). However, at low concentration of arsenic, cell membrane can protect the cell from toxic effect and adsorb a significant amount of arsenic from the culture environment. The adsorption of arsenic by cell membrane has been influenced by numerous factors such as light, temperature, pH, arsenic concentration, etc. In the present study, the effect of light intensity in arsenic adsorption was conducted. The results demonstrate that algal cell have a potential in adsorption of toxicant (arsenate) and light affects the adsorptive ability of cell and cell membranes. Somehow, light induce the removal ability of arsenic by cell membrane. The work was promising to be applied for the arsenic removal from the arsenic contaminated water. The toxic effect of arsenic upon on the biomembrane was studied via the interaction between arsenate and liposome membrane. The results show that arsenic attacked biological membrane by the substitution of choline head of the phospholipid molecule (the structural unit constitutes the biological membrane). Hội thảo Môi trường và Phát triển bền vững, Vườn Quốc gia Côn Đảo, 18/06/2010 – 20/06/2010 Workshop on Environment and Sustainable Development, Con Dao National Park, 18th – 20th June 2010 __________________________________________________________________________________________ Cơ chế gây độc Arsen và khả năng giải độc Arsen của Vi sinh vật 83 Trần Thị Thanh Hương, Lê Quốc Tuấn – Đại học Nông Lâm Tp. HCM 1. GIỚI THIỆU Arsen là một trong những chất có độc tính cao. Con người có thể bị phơi nhiễm arsen qua hít thở không khí, hấp thu thức ăn và qua nước uống. Một lượng nhỏ arsen trong nước có thể đe dọa đến sức khỏe con người bởi vì phần lớn các hợp chất arsen trong nước uống đều ở dạng vô cơ rất độc (Abernathy và cs, 2003). Hầu hết sự nhiễm arsen được phát hiện sau quá trình phơi nhiễm arsen trong nước uống. Lý do chính cho tình trạng này là hầu hết các hợp chất arsen trong thức ăn thường ở dạng hữu cơ và ít độc hoặc không độc. Trong nhiều trường hợp, sự phơi nhiễm arsen từ nước uống là phơi nhiễm với các hợp chất arsen vô cơ rất độc và phơi nhiễm với nồng độ cao (Winski, 1995). Hai dạng tồn tại chính của arsen vô vơ được tìm thấy trong môi trường là arsenite (arsen hóa trị 3 hay As III) và arsenate (arsen hóa trị 5 hay As V) (Abernathy và cs, 2003). Trong cơ thể người, cũng như hầu hết động vật có vú, arsen vô vơ bị methyl hóa tạo thành acid monomethylarsonic và dimethylarsinic bởi phản ứng khử luân phiên arsen từ hóa trị V thành hóa trị III và gắn thêm một nhóm methyl. Nhiều năm qua, người ta tin rằng độc tính cấp của arsen vô cơ mạnh hơn arsen hữu cơ. Do đó, sự methyl hóa arsen vô cơ được xem là một phản ứng khử độc arsen. (Vahter, 2002). Trong tế bào, arsen tồn tại ở các dạng hóa trị +5, +3, 0, và -3 có thể tạo phức với các kim loại và liên kết hóa trị với carbon, hydrogen và sulfur (Ferguson và Gavis, 1972). Bởi vì các thuộc tính sinh hóa của arsenate tương tự phosphate, cho nê ... t and Sustainable Development, Con Dao National Park, 18th – 20th June 2010 __________________________________________________________________________________________ Cơ chế gây độc Arsen và khả năng giải độc Arsen của Vi sinh vật 87 Trần Thị Thanh Hương, Lê Quốc Tuấn – Đại học Nông Lâm Tp. HCM • Rối loạn thần kinh có các biểu hiện như: viêm dây thần kinh ngoại vi cảm giác vận động, có thể đây là biểu hiện độc nhất của Arsen mãn tính. Ngoài ra, có thể có các biểu hiện khác như tê đầu các chi, đau các chi, bước đi khó khăn, suy nhược cơ (chủ yếu ở các cơ duỗi ngón tay và ngón chân). • Nuốt phải hoặc hít thở Arsen trong không khí một cách thường xuyên, liên tiếp có thể dẫn tới các tổn thương, thoái hoá cơ gan, do đó dẫn tới xơ gan. • Arsen có thể tác động đến cơ tim. • Ung thư da có thể xảy ra khi tiếp xúc với Arsen như thường xuyên hít phải Arsen trong thời gian dài hoặc da liên tục tiếp xúc với Arsen. • Rối loạn toàn thân ở người tiếp xúc với Arsen như gầy, chán ăn. Ngoài tác dụng cục bộ trên cơ thể người tiếp xúc do tính chất ăn da của các hợp chất Arsen, với các triệu chứng như loét da gây đau đớn ở những vị trí tiếp xúc trong thời gian dài hoặc loét niêm mạc mũi, có thể dẫn tới thủng vách ngăn mũi. Hình 2.2. Một số hình ảnh biểu hiện các bệnh do nhiễm độc Arsen gây ra 2.2. Cơ chế gây độc của arsen lên màng tế bào Màng tế vào được xem là một “bức tường” chống lại sự tấn công của các độc chất (Zang và cs, 2000). Để hiểu sâu hơn về các phản ứng của màng với độc chất, các thí nghiệm được tiến hành bằng cách sử dụng liposome làm đối tượng nghiên cứu và độc chất ở đây vẫn được sử dụng là arsenate. Các kết quả thí nghiệm cho thấy liposome bị hóa lỏng và phá hủy bởi arsenate. Điều này được xem như là một bằng chứng cho thấy arsenic đã liên kết với liposome và tác động trực Hội thảo Môi trường và Phát triển bền vững, Vườn Quốc gia Côn Đảo, 18/06/2010 – 20/06/2010 Workshop on Environment and Sustainable Development, Con Dao National Park, 18th – 20th June 2010 __________________________________________________________________________________________ Cơ chế gây độc Arsen và khả năng giải độc Arsen của Vi sinh vật 88 Trần Thị Thanh Hương, Lê Quốc Tuấn – Đại học Nông Lâm Tp. HCM tiếp lên chúng. Tuy nhiên, liên kết hóa học của arsenic với các phân tử POPC liposome có thể đã diễn ra sau khi chúng liên kết một cách lỏng lẻo với liposome. Arsenic liên kết với màng ở mức khá cao ngay khi bắt đầu quá trình tương tác cho thấy sự liên kết nhanh chóng của arsenate trong dung dịch màng. Sự giải phóng sau khi liên kết nhanh cũng có thể xuất phát từ động thái chuyển arsenic từ các vị trí ưu tiên trên màng đến các dạng bền vững hơn ở trên màng và trong tế bào chất (Winski và Barbe, 1995). Một báo cáo khoa học gần đây về As (III) cho thấy arsenite có lẽ tạo các liên kết hydrogen trực tiếp với nhóm phosphate của các phân tử dimyristoylphosphatidylcholine (DMPE) trong quá trình cạnh tranh với các phân tử nước hydrate hóa cũng như các nhóm amino. Sự giảm tương tác giữa các nhóm PE – PE sẽ làm giải phóng các nhóm phosphate và do đó độ linh động của lipid sẽ tăng lên trên bề mặt màng liposome. Do đó, arsenic chèn vào những chỗ trống để lại trên bề mặt ưa nước của màng tế vào (Suwalsky và cs, 2007). 3. VẬT LIỆU VÀ PHƯƠNG PHÁP 3.1. Vật liệu Dung dịch arsenate với nồng độ 60% được mua từ công ty Hóa chất tinh khiết Wako (Osaka, Nhật bản). Tảo Chlorella vulgaris, đặt mua từ công ty Hóa chất tinh khiết Wako, được sử dụng sau quá trình tinh lọc trong đó dung dịch tế bào tảo được ly tâm ở 3000 vòng/phút trong 5 phút và phần nổi bên trên được loại bỏ. Và tảo lắng bên dưới được sử dụng cho các thí nghiệm phân tích về sau. Các hóa chất khác đều đạt tiêu chuẩn phân tích trong phòng thí nghiệm. 3.2. Phương pháp Tế bào tảo chlorella được nuôi trong môi trường dinh dưỡng Proteos (dựa theo môi trường Bristol) có đầy đủ các dưỡng chất cho sự sinh trưởng và phát triển của tảo chlorella. Tảo tinh khiết dùng cho các nghiên cứu được mua từ Công ty hóa chất Wako, Nhật bản, sau đó được phân lập bằng cách ly tâm ở 3000 vòng/phút trong 5 phút. Tảo lắng xuống đáy sau ly tâm được dùng cho các nghiên cứu về sau. Nuôi cấy tế bào tảo trong môi trường dinh dưỡng có bổ sung arsenate với các nồng độ khác nhau. Sau các thời gian nuôi khác nhau từ 6 giờ đến 48 giờ đem phân tích các dẫn xuất arsenic được tạo thành trong màng tế bào bằng sắc ký lỏng cao áp kết hợp với máy hấp phụ nguyên tử. Mục đích của nghiên cứu này là nhằm xác định khả năng hấp thu, chuyển hóa arsenic của tảo. Hệ thống sắc ký lỏng cao áp được trang bị máy bơm FCV-10AL có hệ thống khử bọt khí DGU-20A3, một đầu đọc UV-vis SPD-10A cùng với hệ thống đọc phổ LC-10AD. Dữ liệu phổ được theo dõi ở bước sóng 254 nm. Pha di động là acetonitrile/nước (có tỉ lệ 65/35 về thể tích) với tốc độ 1 mL/phút và được duy trì ở nhiệt độ 300C. Cột sặc ký ODS-SP (0.46 cm x 2.5 cm) được sử dụng trong suốt quá trình nghiên cứu. Hội thảo Môi trường và Phát triển bền vững, Vườn Quốc gia Côn Đảo, 18/06/2010 – 20/06/2010 Workshop on Environment and Sustainable Development, Con Dao National Park, 18th – 20th June 2010 __________________________________________________________________________________________ Cơ chế gây độc Arsen và khả năng giải độc Arsen của Vi sinh vật 89 Trần Thị Thanh Hương, Lê Quốc Tuấn – Đại học Nông Lâm Tp. HCM Arsenic được phân tích bởi hệ thống máy hấp phụ nguyên tử được nối với với hệ thống hóa hơi. Với hệ thống này thì nồng độ arsenic thấp nhất có thể phát hiện được là 1 ppb. Các thí nghiệm được lặp lại từ 3 – 5 lần và số liệu thu được được xử lý bằng các phương pháp thống kê. Thí nghiệm với điều kiện ánh sáng và che tối. Tế bào tảo tinh khiết được ủ với arsen với các nồng độ khác nhau nhằm đánh giá ảnh hưởng độc của arsen lên tế bào sống. Tảo C. vulgaris với nồng độ 1010 cells/L được nuôi trong môi trường Proteos, chỉnh sửa từ môi trường Bristol (Nichols, 1973), với các nồng độ arsenate (H3AsO4) khác nhau dưới ánh sáng của đèn neon có cường độ sáng là 3000 lux ở 300C. Trong thí nghiệm về ảnh hưởng của ánh sáng đến khả năng hấp thu arsen của tảo, điều kiện che tối 100% được thực hiện (Hình 3.1). Teábaøo trong dung dòch arsen Phaù huûy teá baøo bôûi soùng sieâu aâm Hieäu suaát haáp thu arsen cuûa teá baøo vaø maøng teá baøo Xaùc ñònh arsen lieân keát treân maøng baèng AAS Lipid vaø Arsenolipid As Taùch lipid maøng Teábaøo trong dung dòch arsen Hình 3.1. Quá trình phân tích arsen liên kết với màng ở các điều kiện chiếu sáng khác nhau. Sau khi ủ với arsenate, tế bào được phá hủy bởi máy siêu âm cao tần, lipid màng được tách chiết bằng hỗn hợp dung môi chloroform: methanol: nước (với tỉ lệ 2:1:0.8 về thể tích). Arsonolipid, lipid có chứa arsen, được xác định bằng máy đo phổ hấp phụ nguyên tử (Atomic Absorption Spectrometry - AAS). Arsen tự do còn lại trong môi trường cũng được định lượng bằng AAS để đánh giá hiệu suất hấp thu arsen của tế bào và màng tế bào dưới các điều kiện thí nghiệm khác nhau. Các quá trình phân tích sự lưu giữ arsen bởi tế bào được mô tả qua Hình 3.2. Hội thảo Môi trường và Phát triển bền vững, Vườn Quốc gia Côn Đảo, 18/06/2010 – 20/06/2010 Workshop on Environment and Sustainable Development, Con Dao National Park, 18th – 20th June 2010 __________________________________________________________________________________________ Cơ chế gây độc Arsen và khả năng giải độc Arsen của Vi sinh vật 90 Trần Thị Thanh Hương, Lê Quốc Tuấn – Đại học Nông Lâm Tp. HCM Tảo Chlorella vulgaris Ly tâm 3000 vòng/phút trong 5 phút Dịch lỏng bên trên Thải Tảo Bổ sung As (V) + NaOH 1M Khuấy trong 30 phút Tảo Thải Dịch lỏng bên trên Xác định hợp chất có chứa arsenic Ly tâm 3000 vòng/phút trong 5 phút Hình 3.2. Quá trình phân tích sự hấp thu arsen của tế bào. 4. KẾT QUẢ VÀ THẢO LUẬN 4.1. Hiệu suất hấp thu arsen của tế bào. Nuôi ủ tảo với arsenate trong môi trường dinh dưỡng (đã được mô tả trong phần vật liệu và phương pháp) trong 24 giờ, dịch nuôi sau khi tách tảo được phân tích để tính hiệu suất hấp thu arsen của tế bào tảo. Các kết quả cho thấy khi tăng nồng độ arsen bổ sung vào thì hiệu suất hấp thu arsen của tảo giảm cho dù nồng độ arsen được hấp thu tăng lên (Hình 4.1.). Quan sát dưới kính hiển vi huỳnh quang cũng cho thấy, nồng độ arsen cao trong dịch nuôi đã phát hủy màng tế bào tảo và làm cho tảo chết một cách nhanh chóng (Tuan và cs, 2008). Do đó, nồng độ cao arsen làm cho tế bào tảo dễ dàng bị chết hoặc hoạt động của tế bào bị dừng lại, kết quả là làm giảm hiệu suất hấp thu arsen của tế bào. Vai trò của màng tế bào trong việc hấp thu arsen cũng được làm rõ và phản ứng tương tác giữa arsen và màng tế bào đang được nghiên cứu. Kết quả sẽ được công bố trong các báo 0 50 100 11.25 7.5 3.75 H iệ u su ất (% ) Nồng độ arsen bổ sung vào dung dịch (mg/L) Hình 4.1. Hiệu suất hấp thu arsen của tế bào ở các nồng độ arsen bổ sung khác nhau vào trong dịch nuôi. Hội thảo Môi trường và Phát triển bền vững, Vườn Quốc gia Côn Đảo, 18/06/2010 – 20/06/2010 Workshop on Environment and Sustainable Development, Con Dao National Park, 18th – 20th June 2010 __________________________________________________________________________________________ Cơ chế gây độc Arsen và khả năng giải độc Arsen của Vi sinh vật 91 Trần Thị Thanh Hương, Lê Quốc Tuấn – Đại học Nông Lâm Tp. HCM cáo sau. 4.2. Ảnh hưởng của ánh sáng lên sự hấp thu arsen của tế bào. Hàm lượng arsen được hấp thu tăng lên trong thời gian ủ. Kết quả cho thấy hiệu suất hấp thu arsen trong tối cao hơn ngoài sáng sau 24 giờ ủ. Tuy nhiên, khi tăng thời gian ủ lên thì hiệu suất hấp thu arsen trong tối bắt đầu có hiện tượng chững lại, trong khi đó trong điều kiện có ánh áng thì tảo vẫn tiếp tục tăng cao hiệu suất hấp thu arsen (Hình 4.2). Điều này cho thấy ánh sáng đã làm tăng cường hiệu quả hấp thu arsen của tế bào. Hơn nữa, trong điều kiện có ánh sáng thì việc quang hợp bình thường và tạo điều kiện cho việc tăng sinh tế bào, do đó làm gia tăng hiệu quả hấp thu. Trong điều kiện che tối, arsen vẫn được tế bào hấp thu bằng cơ chế vận chuyển thụ động qua màng. Tuy nhiên, hoạt động quang hợp của tế bào không diễn ra trong thời gian dài sẽ làm cho tế bào tảo không sinh sản và có thể chết đi, do đó thời gian ủ càng lâu thì hiệu suất hấp thu sẽ giảm dần. Kết quả phân tích lipid tách chiết từ màng tế bào sau khi nuôi tảo với arsen cho thấy arsen liên kết trực tiếp với lipid màng và hàm lượng arsen liên kết với màng cũng tăng lên theo thời gian ủ. Tuy nhiên, hàm lượng arsen liên kết với màng trong điều kiện trong tối vẫn cao hơn so với ngoài sáng (Hình 4.3). Điều này có thể giải thích các tế bào sống trong điều kiện có chiếu sáng thì mọi hoạt động sống diễn ra bình thường trong đó có hoạt động loại thải độc chất. Do đó, màng tế bào có khả năng loại thải arsen ra khỏi màng một cách chủ động và các phản ứng sửa sai trên màng cũng diễn ra, cho nên mới xảy ra hiện tượng màng tế bào trong điều kiện chiếu sáng hấp thu arsen ít hơn màng tế bào trong điều kiện che tối. Hình 4.2. Hiệu suất hấp thu arsen của tế bào. (1) Trong điều kiện không có ánh sáng, (2) trong điều kiện có sánh sáng. Tế bào (1010 tb/L) ủ với 7.5 mg/L arsen trong môi trường dinh dưỡng 0 10 20 30 40 50 0 20 40 60 80 100 (1) (2) Thời gian ủ (giờ) H iệ u su ất hấ p th u ar se n củ a tế bà o (% ) 0 10 20 30 40 50 -10 0 10 20 30 40 50 60 70 (1) (2) Thời gian ủ (giờ) H àm lư ợ ng ar se n (n g) tr on g 1 m g lip id tá ch từ m àn g tế bà o Hình 4.3. Khả năng hấp thu arsen của màng tế bào trong các điều kiện che tối (1) và chiếu sáng (2). Hội thảo Môi trường và Phát triển bền vững, Vườn Quốc gia Côn Đảo, 18/06/2010 – 20/06/2010 Workshop on Environment and Sustainable Development, Con Dao National Park, 18th – 20th June 2010 __________________________________________________________________________________________ Cơ chế gây độc Arsen và khả năng giải độc Arsen của Vi sinh vật 92 Trần Thị Thanh Hương, Lê Quốc Tuấn – Đại học Nông Lâm Tp. HCM Tóm lại, trong cả 2 điều kiện che tối và chiếu sáng, màng tế bào đều có khả năng hấp thu arsen với hàm lượng cao. Tuy nhiên, ánh sáng đã tăng cường hoạt động loại thải độc chất ra khỏi màng tế bào một cách hiệu quả trong hoạt động sống của tế bào. 5. KẾT LUẬN VÀ KIẾN NGHỊ Tế bào tảo có khả năng hấp thu arsen với hiệu suất cao. Sự hấp thu arsen phụ thuộc vào các điều kiện môi trường, đặc biệt là ánh sáng. Phản ứng ban đầu giữa tế bào và arsen diễn ra chủ yếu trên màng. Do đó, màng tế bào với nhiều chức năng khác nhau không chỉ bảo vệ các cấu thành bên trong nó mà còn phản ứng với các độc chất và chuyển hóa độc chất thành những chất không độc. Màng tế bào đóng vai trò quan trọng trong quá trình loại thải độc chất một cách chủ động qua các phản ứng đặc hiệu trên màng, trong trường hợp nghiên cứu cụ thể này là arsen. Sự liên kết của arsen với màng là một phần không thể thiếu trong các phản ứng giữa màng và độc chất arsen. Sự liên kết hoặc thay thế gốc phosphate hoặc choline của phân tử phopholipid màng bởi arsen cũng đã được chứng minh (Tuấn và cs, 2008). Các cấu trúc màng bên trong tế bào chất cũng có khả năng khử độc tính của arsen bằng một số các cơ chế mà hiện nay đang được nghiên cứu bởi các nhà khoa học nhằm giải thích khả năng tồn tại của tế bào và cơ thể sinh vật trong điều kiện nhiễm độc arsen với nồng độ cao. TÀI LIỆU THAM KHẢO 1. Abernathy C. O. et al., 2003. Journal of Nutrition, 133, 1536-1538. 2. Barchowsky, A., Roussel, R.R., Klei, L.R., James, P.E., Ganju, N., Smith, K.R., Dudek, E.J., 1999. Toxicology and Applied Pharmacology, 159, 65–75. 3. Delnomdedieu M. et al., 1995. Chemico-Biological Interactions, 98, 69 – 83. 4. Ferguson J. C. et al., 1972. Water Research, 6, 1259-1274. 5. Gresser M. J., 1981. Journal of Biological Chemistry, 256, 5981-5983. 6. Lynn, S., Gurr, J.R., Lai, H.T., Jan, K.Y., 2000. Circulation Research, 86, 514–519. 7. Moore S. A. et al., 1983. Journal of Biological Chemistry, 258, 6266-6271. 8. Styblo M. and Thomas D. J., 1997. Toxicology and Applied Pharmacology 147, 1 – 8. 9. Tseng C., 2004. Toxicology and Applied Pharmacology, 197, 67– 83 (2004). 10. Tuan L. Q. et al., 2008. Toxicology in Vitro, 22, 1632 – 1638. 11. Vahter M., 2002. Toxicology, 181, 211-217. 12. Winski S. L. and Carter, D. E., 1995. Journal of Toxicological Environment and Health, 46, 379–397. 13. Winski, S.L., Barber, D.S., Rael, L.T., Carter, D.E., 1997. Fundamental and Applied Toxicology, 38, 123 – 128. 14. Winski, S.L., Carter, D.E., 1998. Journal of Toxicology and Environmental Health Part A, 53, 345 – 55. Zhang, T.L., Gao. Y.X., Lu, J.F., Wang, K., 2000. Journal of Inorganic Biochemistry, 79,
File đính kèm:
 co_che_gay_doc_arsen_va_kha_nang_giai_doc_arsen_cua_vi_sinh.pdf
co_che_gay_doc_arsen_va_kha_nang_giai_doc_arsen_cua_vi_sinh.pdf

