Bài giảng Các quá trình sinh học trong kỹ thuật môi trường - Chương 2, Phần 1: Động học quá trình sinh học - Lê Hoàng Nghiêm
Xác định nồng độ theo thời gian của một chất
khuếch tán không phản ứng trong một bể
phản ứng xáo trộn hoàn toàn với các điều
kiện sau đây:
i. Nồng độ đầu vào: Cin = 300 mg/L xả liên tục
ii. Lưu lượng: Q = 700 m3/ngày
iii. Nồng độ ban đầu : Co = 50 mg/L
iv. Thể tích của bể là : V = 200 m
Một hệ thống xử lý nước thải sinh hoạt bao
gồm dãy 2 hồ sinh học xáo trộn hoàn toàn, hồ
thứ nhất có thời gian lưu nước là 10 ngày, và hồ
thứ 2 có thời gian lưu nước là 5 ngày. Hãy kiểm
tra hệ thống hồ trên có đáp ứng được hiệu quả
xử lý loại bỏ 99,9% coliform theo tốc độ chết
bậc 1 của vi sinh vật hay không? Biết rằng
hằng số tốc chết bậc 1, k của vi sinh vật là một
hàm của thời gian lưu nước k = 0,2θ – 0,3

Trang 1
Trang 2

Trang 3

Trang 4
Trang 5

Trang 6

Trang 7

Trang 8

Trang 9

Trang 10
Tải về để xem bản đầy đủ
Tóm tắt nội dung tài liệu: Bài giảng Các quá trình sinh học trong kỹ thuật môi trường - Chương 2, Phần 1: Động học quá trình sinh học - Lê Hoàng Nghiêm

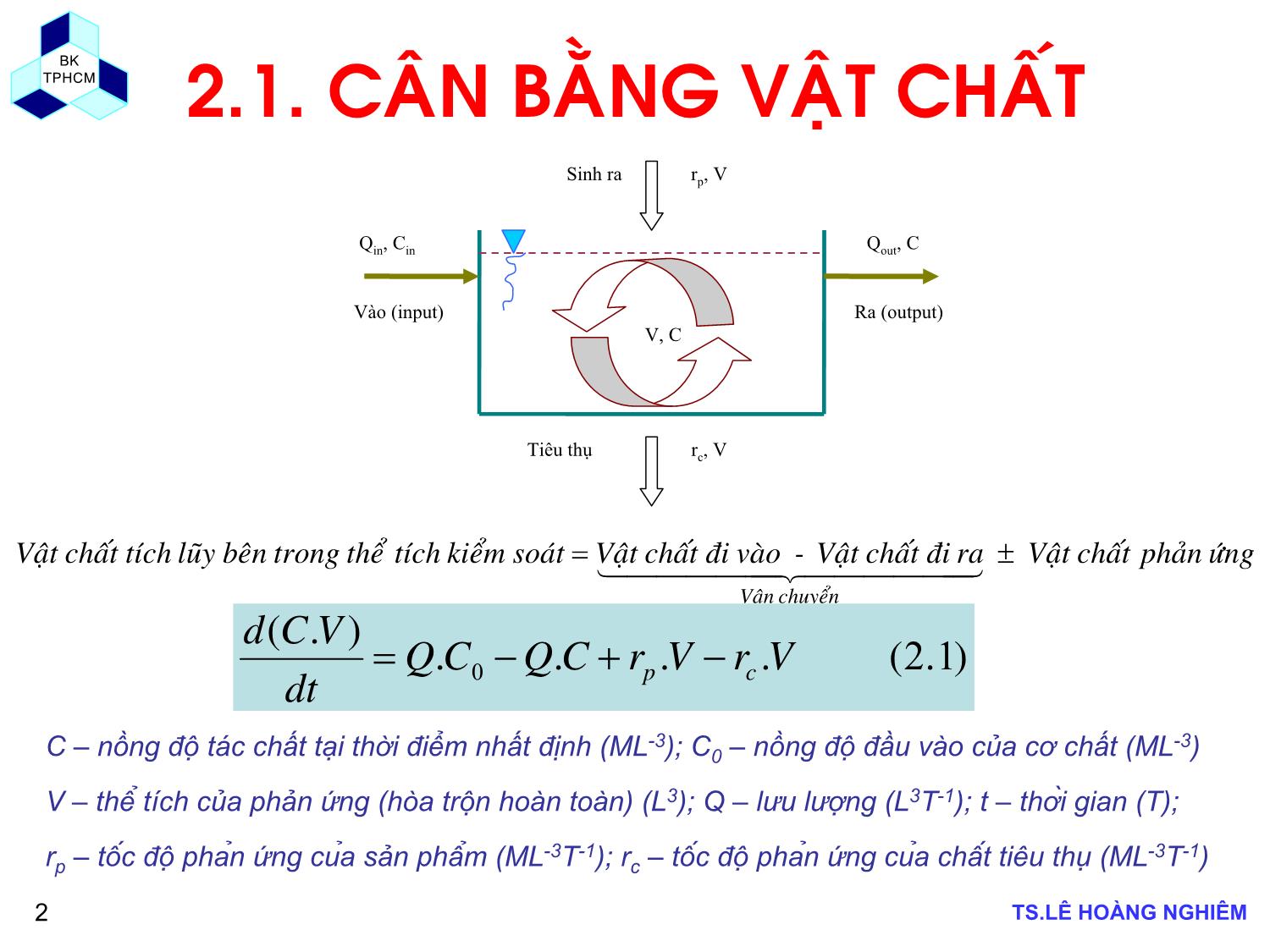
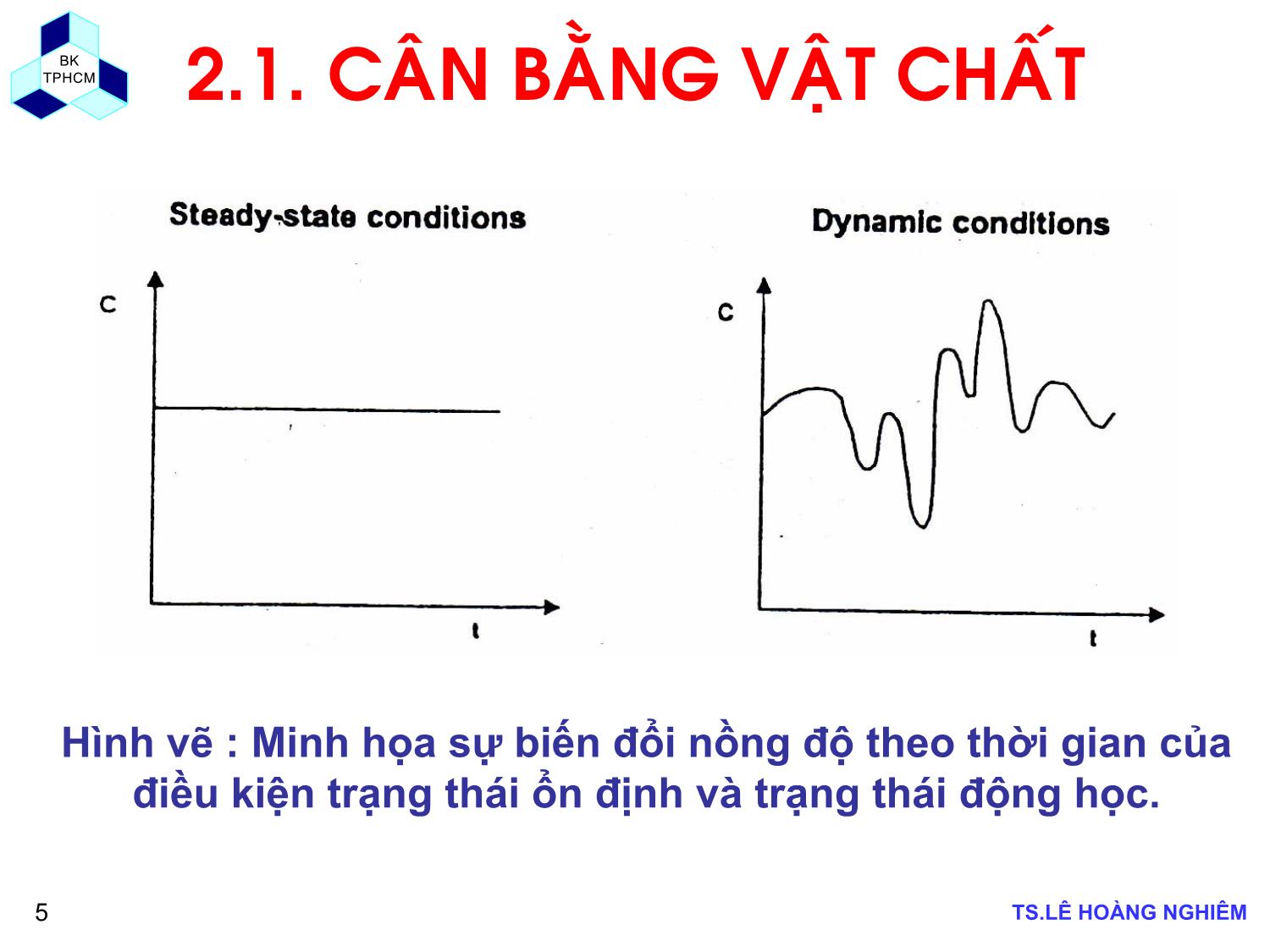
BK TPHCM BÀI GIẢNG MÔN HỌC CÁC QUÁ TRÌNH SINH HỌC TRONG CÔNG NGHỆ MÔI TRƯỜNG CHƯƠNG 2: ĐỘNG HỌC QUÁ TRÌNH SINH HỌC GVHD: TS. Lê Hoàng Nghiêm Email: hoangnghiem72@gmail.com hoangnghiem72@yahoo.com BK TPHCM TS.LÊ HỒNG NGHIÊM2 2.1. CÂN BẰNG VẬT CHẤT ứng phảnchất Vật ra đichất Vật - vào đichất Vật soát kiểm tích thể trong bên lũy tíchchất Vật chuyển Vận ±= 444444 344444 21 Qout , C V, C Qin , Cin rp , V rc , V Sinh ra Tiêu thụ Vào (input) Ra (output) ).(....).( 120 VrVrCQCQdt VCd cp −+−= C – nồng đơ ̣ tác chất tại thời điểm nhất định (ML-3); C0 – nồng đợ đầu vào của cơ chất (ML-3) V – thê ̉ tı́ch của phản ứng (hịa trộn hồn tồn) (L3); Q – lưu lượng (L3T-1); t – thời gian (T); rp – tơ ́c đợ phản ứng của sản phẩm (ML-3T-1); rc – tơ ́c đợ phản ứng của chất tiêu thụ (ML-3T-1) BK TPHCM TS.LÊ HỒNG NGHIÊM3 2.1. CÂN BẰNG VẬT CHẤT Phương trình (2.1) cĩ thể triển khai vế trái và biểu diễn dước dạng sau : Thể tích bể phản ứng thường là cố định (dV/dt = 0) ta cĩ: ).(...... 220 VrVrCQCQdt dCV dt dVC cp ++−=+ ).(..... 320 VrVrCQCQdt dCV cp −+−= ).(....).( 120 VrVrCQCQdt VCd cp −+−= BK TPHCM TS.LÊ HỒNG NGHIÊM4 2.1. CÂN BẰNG VẬT CHẤT Trạng thái ổn định và trạng thái động học Mơ hình tốn học của hệ thống cĩ thể xây dựng ở hai điều kiện trạng thái: 9Trạng thái ổn định (steady state); và 9Trạng thái động học (dynamic state) Trạng thái ổn định (steady state) là trạng thái khơng cĩ tích lũy vật chất trong hệ thống, dC/dt = 0, nghĩa là nồng độ của chất phản ứng trong hệ thống là hằng số. Phương trình (2.3) trở thành: 0 = Q.C0 – Q.C + rp .V – rc .V (2.4) Trạng thái động học (dynamic state) là trạng thái cĩ sự tích lũy khối lượng vật chất trong hệ thống. Vì vậy, dC/dt =/ 0. Nồng độ của chất phản ứng thay đổi theo thời gian và cĩ thể tăng hay giảm. BK TPHCM TS.LÊ HỒNG NGHIÊM5 2.1. CÂN BẰNG VẬT CHẤT Hình vẽ : Minh họa sự biến đổi nồng độ theo thời gian của điều kiện trạng thái ổn định và trạng thái động học. BK TPHCM TS.LÊ HỒNG NGHIÊM6 BÀI TẬP 2.1 CÂN BẰNG HÓA CHẤT ĐỘC HẠI TRONG HỒ. Tính toán nồng độ hoá chất độc hại trong hồ ở trạng thái ổn định khi biết lưu lượng nước thải vào hồ bằng lưu lượng nước chảy ra khỏi hồ Qin = Qout = 10 m3/s, nồng độ chất độc hại trong nước thải là 100 μg/L và khối lượng phân hủy của chất độc hại là 50 kg/ngày. BK TPHCM TS.LÊ HỒNG NGHIÊM7 2.2.1 BỂ PHẢN ỨNG DẠNG MẺ (BACTH REACTOR) Bởi vì Qin = 0 và Q = 0 trong bể phản ứng dạng mẽ nên phương trình (2.5) trở thành: Phương trình cân bằng khối lượng: Cánh khuấy ).( 52kCVQCQC dt dCV in −−= ).( 62kC dt dC −= ).( 72kt C dC −= ).( 82ktoeCC −= Giải phương trình vi phân trên ta được: BK TPHCM TS.LÊ HỒNG NGHIÊM8 2.2.2 BỂ PHẢN ỨNG DÒNG CHẢY LIÊN TỤC XÁO TRỘN HOÀN TOÀN (CFSTR – CONTINUOUS FLOW STIRRED TANK REACTOR) (1) Phương trình trên có thể viết ở dạng đơn giản bằng các giả thiết sau: 1. Nồng độ dòng vào Cin là hằng số. 2. Lưu lượng vào và ra không đổi (Qin = Qout = Q= constant) và thể tích V là không đổi (dV/dt = 0). 3. Sự biến thiên nồng độ C xảy ra bên trong bể phụ thuộc vào phản ứng bậc 1 (r = -kC, dấu trừ chỉ rằng phản ứng phân hủy). Qout , C V, C Qin , Cin ứngphảngiatham Lượng rachất Vật - vàochất Vật tíchthể trongchất vật thiên Biến ±= ).()( 92rVCQCQ dt VC outinin ±−=Δ ).()( 102rVCQCQdt VCd outinin ±−= ).( 112kCVQCQC dt dCV in −−= BK TPHCM TS.LÊ HỒNG NGHIÊM9 2.2.2 BỂ PHẢN ỨNG DÒNG CHẢY LIÊN TỤC XÁO TRỘN HOÀN TOÀN (CFSTR – CONTINUOUS FLOW STIRRED TANK REACTOR) (2) a. Đối với trường hợp hóa chất dạng bảo toàn (không phản ứng, r =0): ).()( 122CCQ dt dCV in −= ).( 1321 CC dCdt in − =θ Đặt θ=V/Q là thời gian lưu nước trung bình (giả sử là hằng số), ta có: ).()( 1421 11 t o t in eCeCC θθ −− +−= ).()( 1521 1 t in eCC θ −−= Giải phương trình vi phân trên ta được: Nếu Co = 0, ta có: BK TPHCM TS.LÊ HỒNG NGHIÊM10 BÀI TẬP 2.2 BỂ PHẢN ỨNG CFSTR Xác định nồng độ theo thời gian của một chất khuếch tán không phản ứng trong một bể phản ứng xáo trộn hoàn toàn với các điều kiện sau đây: i. Nồng độ đầu vào: Cin = 300 mg/L xả liên tục ii. Lưu lượng: Q = 700 m3/ngày iii. Nồng độ ban đầu : Co = 50 mg/L iv. Thể tích của bể là : V = 200 m3 BK TPHCM TS.LÊ HỒNG NGHIÊM11 2.2.2 BỂ PHẢN ỨNG DÒNG CHẢY LIÊN TỤC XÁO TRỘN HOÀN TOÀN (CFSTR – CONTINUOUS FLOW STIRRED TANK REACTOR) (3) b. Đối với trường hợp hóa chất phản ứng (r = -kC) : Giải phương trình vi phân trên ta được: Ở trạng thái ổn định (steady state condition), (dC/dt = 0), ta có kCC V QC V Q dt dC in −−= inCV QCk V Q dt dC =++ )( ( ) ( ) ).()( // 1621 1 11 tkintk o ek CeCC θθ θ +−+− −++= ).( 172 1 θk C kVQ QCC inin +=+= BK TPHCM TS.LÊ HỒNG NGHIÊM12 2.2.3 DÃY BỂ PHẢN ỨNG DÒNG CHẢY LIÊN TỤC XÁO TRỘN HOÀN TOÀN Phương trình cân bằng khối lượng cho bể phản ứng (hồ) thứ nhất: Q Cn Q Cn-1 Q C2 Q C1 Q Cin V, C1 V, C2 V, Cn Bể thứ 1 Bể thứ 2 Bể thứ n VkCQCQC dt dCV in 111 −−= Lời giải cho bể phản ứng (hồ) thứ nhất là: ).( 182 11 θk CC in+= Phương trình cân bằng khối lượng cho bể phản ứng (hồ) thứ hai: VkCQCQC dt dCV 2212 −−= ( ) ).( 1921 22 θk CC in+=Lời giải cho bể phản ứng (hồ) thứ hai là: Lời giải cho bể phản ứng (hồ) thứ n là: ( ) ).( 2021 ninn k CC θ+= BK TPHCM TS.LÊ HỒNG NGHIÊM13 BÀI TẬP 2.3 DÃY BỂ PHẢN ỨNG CFSTR Một hệ thống xử lý nước thải sinh hoạt bao gồm dãy 2 hồ sinh học xáo trộn hoàn toàn, hồ thứ nhất có thời gian lưu nước là 10 ngày, và hồ thứ 2 có thời gian lưu nước là 5 ngày. Hãy kiểm tra hệ thống hồ trên có đáp ứng được hiệu quả xử lý loại bỏ 99,9% coliform theo tốc độ chết bậc 1 của vi sinh vật hay không? Biết rằng hằng số tốc chết bậc 1, k của vi sinh vật là một hàm của thời gian lưu nước k = 0,2θ – 0,3. BK TPHCM TS.LÊ HỒNG NGHIÊM14 2.2.4 HỆ THỐNG DÒNG CHẢY NÚT (PLUG-FLOW SYSTEM) (1) Chia 2 vế cho AΔx ta có : Cân bằng khối lượng cho một phân tử thể tích ΔV=AΔx như trên hình vẽ Δ x AVào QCx+Δx x x+Δ x QCx Δ V ΔV = AΔx Ra ( ) ( ) ).( 212xrAx x CxCQxQCxA t C Δ+⎥⎦ ⎤⎢⎣ ⎡ Δ∂ ∂+−=Δ∂ ∂ ).( 222r x C A Q t C +∂ ∂−=∂ ∂ BK TPHCM TS.LÊ HỒNG NGHIÊM15 2.2.4 HỆ THỐNG DÒNG CHẢY NÚT (PLUG-FLOW SYSTEM) (2) Xét tốc độ phản ứng r là phản ứng bậc 1: r = -kC, ta có: a) Đối với trạng thái ổn định ta có: ).( 232rdx dC A Q = kC dx dC A Q −= kdx Q A C dC −= Đặt θ=V/Q là thời gian lưu nước, và (A/Q)dx=d θ, ta có: ).( 242θkd C dC −= Giải phương trình vi phân trên ta được: ).( 252θkieCC −= D nồng độ chất ô nhiễm trong dòng ra (ở hạ lưu) là một hàm của nồng độ dòng vào (ở thượng lưu) BK TPHCM TS.LÊ HỒNG NGHIÊM16 2.2.5 HỆ THỐNG DÒNG CHẢY NÚT (PLUG-FLOW SYSTEM) (3) Lấy giới hạn phương trình (2.22) khi Δt → 0 ta có: b) Đối với trạng thái không ổn định ta có: Trong đó: u=Q/A là vận tốc trung bình. 9Đây là phương trình tổng quát của bể phản ứng dòng chảy nút. 9Nồng độ C phụ thuộc vào thời gian t và khoảng cách x. ).( 262kC x CukC x C A Q t C −∂ ∂−=−∂ ∂−=∂ ∂ BK TPHCM TS.LÊ HỒNG NGHIÊM17 BÀI TẬP 2.4 SO SÁNH CÁC HỆ THỐNG BỂ PHẢN ỨNG Quá trình loại bỏ chất ơ nhiễm được đánh giá trong các hệ thống bể phản ứng như sau: 1. Một bể CSFTR 2. Dãy hai bể CSFTR 3. Dãy ba bể CSFTR 4. Một bể phản ứng dịng chảy nút So sánh thời gian lưu nước của các hệ thống bể phản ứng trên với các hiệu quả loại bỏ chất ơ nhiễm 75, 80, 85, 90 và 95%. BK TPHCM TS.LÊ HỒNG NGHIÊM18 2.3. Loại phản ứng và tốc đợ phản ứng 2.3.1 Bậc phản ứng Vận tốc phản ứng của một chất phụ thuộc vào nồng độ của chất phản ứng và phụ thuộc vào nồng độ của một hay nhiều sản phẩm. Tổng quát, tốc độ phản ứng r của các chất tham gia phản ứng A, B, C thường được biểu diễn như sau: K = hằng số tốc độ phản ứng CA , CB , CC là nồng độ của các chất A, B, C a, b, c là các số mũ, các số mũ này cĩ thể bằng hay khơng bằng các hệ số tỉ lượng (hệ số cân bằng) của phương trình phản ứng. Phản ứng này cĩ bậc là a đối với chất phản ứng A, và b đối với chất phản ứng B, và c đối với chất phản ứng C. Bậc tổng cộng của phản ứng (a+b+c). Bậc này cĩ thể là số nguyên hay khơng là số nguyên. ).( 272cC b B a A CCkCr = BK TPHCM TS.LÊ HỒNG NGHIÊM19 2.3. Loại phản ứng và tốc đợ phản ứng 2.3.1 Bậc phản ứng Ví dụ: 9Tốc độ của phản ứng A + B → C là: 9Bậc của phản ứng là bậc 1 đối với A và bậc ½ đối với B. Bậc tổng cộng của phản ứng là 3/2. Hằng số tốc độ phản ứng k là hằng số tỷ lệ trong biểu thức tốc độ phản ứng. 2/1 BACkCr = BK TPHCM TS.LÊ HỒNG NGHIÊM20 2.3 Động học phản ứng - Tốc độ phản ứng 2.3.1 Bậc phản ứng Vận tốc phản ứng, nồng độ của một chất và bậc phản ứng biển diễn như sau: r = kCn (2.28) r – tốc đơ ̣ phản ứng (ML-3L-1) k – hằng sớ phản ứng (T-1) C – nồng đợ thử (ML-3) n – bậc phản ứng Với các giá trị của n khác nhau ta cĩ các loại phản ứng khác nhau như sau: 9n = 0 phản ứng bậc zero 9n = 1 phản ứng bậc 1 9n = 2 phản ứng bậc 2 BK TPHCM TS.LÊ HỒNG NGHIÊM21 2.3. Loại phản ứng và tốc đợ phản ứng 2.3.1 Bậc phản ứng Lấy logarit hai vế của phương trình (2.28) ta cĩ: log r = log k + n log C (2.29) Biển diễn quan hệ của phương trình (2.3) bằng đồ thị cho các giá trị n khác nhau ta cĩ hình vẽ sau. Trên hình vẽ nhận thấy: - Phản ứng bậc zero: biển diễn bằng đường nằm ngang. Tốc độ phản ứng khơng phụ thuộc vào nồng độ chất phản ứng. - Phản ứng bậc 1: Tốc độ phản ứng tỷ lệ thuận với nồng độ chất phản ứng. - Phản ứng bậc 2: Tốc độ phản ứng tỷ lệ thuận với bình phương nồng độ chất phản ứng. BK TPHCM TS.LÊ HỒNG NGHIÊM22 2.3. Loại phản ứng và tốc đợ phản ứng 2.3.2 Phản ứng bậc zero Phản ứng bậc zero là các phản ứng mà trong đĩ vận tốc phản ứng khơng phụ thuộc vào nồng độ chất phản ứng. Trong trường hợp này tốc độ biến đổi nồng độ chất phản ứng là hằng số: Lấy tích phân (2.31) với điều kiện ban đầu C = Co tại t = 0 ta cĩ: ).(. 3020CK dt dC −= ).( 312K dt dC −= ).(. 3220 tKCC −= Hình vẽ 2.2: Phản ứng bậc zero. a) Biến thiên vận tốc phản ứng theo thời gian; b) Biến thiên nồng độ chất phản ứng theo thời gian (a) (b) BK TPHCM TS.LÊ HỒNG NGHIÊM23 2.3. Loại phản ứng và tốc đợ phản ứng 2.3.3 Phản ứng bậc 1 Phản ứng bậc 1 là phản ứng mà tốc đơ ̣ phản ứng tỷ lệ với nồng đợ của chất phản ứng. Lấy tích phân hai vế (2.34) với C = Co tại t = 0, ta cĩ: lnC = lnC0 – K.t (2.9) Hay C = C0 .e-Kt (2.35) ).(. 3321CK dt dC −= ).(. 342CKdt dCHay −= Hình vẽ 2.3: Phản ứng bậc 1. a) Biến thiên vận tốc phản ứng theo thời gian; b) Biến thiên nồng độ chất phản ứng theo thời gian (a) (b) BK TPHCM TS.LÊ HỒNG NGHIÊM24 2.3. Loại phản ứng và tốc đợ phản ứng 2.3.4 Phản ứng bậc 2 Phản ứng bậc 2 là phản ứng mà xảy ra ở tốc đơ ̣ ứng với lũy thừa bậc 2 của một đơn chất phản ứng. Trong phản ứng chuyển đổi một đơn chất thành một sản phẩm: Tốc đơ ̣ mất đi của chất A, đối với phản ứng bậc 2, được biểu diễn theo phương trình: K : hằng sớ tốc đợ phản ứng,khối lượng-1.thể tích.thời gian-1 Lấy tích phân phương trình (2.37) ta được: ).( 3622 PA → ).()( 3722CK dt dCrA =−= ).( 38211 0 Kt CC =− BK TPHCM TS.LÊ HỒNG NGHIÊM25 2.3. Loại phản ứng và tốc đợ phản ứng 2.3.4 Phản ứng bậc 2 Hình vẽ sau cho thấy rằng đờ thi ̣ của 1/C tỉ lê ̣ nghic̣h với thời gian sẽ cho một đường thẳng, đơ ̣ dốc là gia ́ tri ̣của K Thay đổi các gia ́ tri ̣ thực nghiệm của C và t, phương trình (1.30) và (1.33), va ̀ (1.36) cĩ thê ̉ được sử duṇg để kiểm tra bậc của phản ứng đặc biệt. Việc này hồn tồn tương thích với việc nồng đợ tỉ lê ̣ nghic̣h với thời gian va ̀ khơng cĩ sự sai lệch nào so với đường thẳng BK TPHCM TS.LÊ HỒNG NGHIÊM26 2.3. Loại phản ứng và tốc đợ phản ứng 2.3.5. Phản ứng bão hịa Các phản ứng trong xử lý chất thải bằng phương pháp sinh học đều dựa trên phản ứng enzyme Động học của các phản ứng này dựa vào mơ hình của Michaelis và Menten để mơ tả động học của sự tăng trưởng của vi sinh vật và phản ứng phân hủy trong nước thải. Vận tốc phản ứng cĩ dạng hàm hyperbol, trong đĩ vận tốc cĩ xu hướng đạt đến giá trị bão hịa: Trong đo ́: r – tốc đợ phản ứng (ML-3T-1) rmax – tốc đợ phản ứng lớn nhất (ML-3T-1) S – nồng đợ cơ chất (ML-3) KS – hằng sớ bán bão hịa (ML-3) ).(.max 392SK Srr S + = BK TPHCM TS.LÊ HỒNG NGHIÊM27 2.3. Loại phản ứng và tốc đợ phản ứng 2.3.5. Phản ứng bão hịa a. Khi nồng độ chất nền hay cơ chất cao S >>Ks : xấp xĩ phản ứng bậc zero Khi nồng độ chất nền lớn hơn giá trị Ks nhiều, cĩ thể bỏ qua Ks trong mẫu số của (2.39), khi này ta cĩ: r = rmax (2.40) Khi này vận tốc phản ứng r là hằng số và bằng với tốc độ lớn nhất rmax. Phản ứng tuân theo phản ứng bậc zero, vận tốc phản ứng khơng phụ thuộc nồng độ chất nền hay cơ chất. Trong xử lý nước thải trường hợp này cĩ thể xảy ra ở phần đầu bể phản ứng dịng chảy nút (plug-flow reactor) vì ở đây nồng độ chất nền cao. ).(.max 392SK Srr S + = BK TPHCM TS.LÊ HỒNG NGHIÊM28 2.3. Loại phản ứng và tốc đợ phản ứng 2.3.5. Phản ứng bão hịa b. Khi nồng độ chất nền thấp S << Ks : xấp xĩ phản ứng bậc thấp Khi nồng độ chất nền thấp hơn giá trị Ks nhiều, S cĩ thể được bỏ qua trong mẫu số (2.39), ta cĩ; Bởi vì rmax và Ks là hai hằng số nên số hạng (rmax/Ks) cũng là hằng số và cĩ thể thay thế bằng hằng số mới K. Khi này (2.13) trở thành: r = K.S (2.42) Trong trường hợp này vận tốc phản ứng tỷ lệ thuận với nồng độ chất nền. Phản ứng tuân theo động học phản ứng bậc 1. Trong xử lý nước thải trường hợp này cĩ thể xảy ra trong bể phản ứng xáo trộn hồn tồn (completed-mix reactor) vì ở đây nồng độ chất nền thấp do yêu cầu đầu ra thấp. ).(.max 392SK Srr S + = ).(.max 412 SK Srr = BK TPHCM TS.LÊ HỒNG NGHIÊM29 2.3. Loại phản ứng và tốc đợ phản ứng 2.3.5. Phản ứng bão hịa Hình vẽ biểu diễn hai trường hợp tới hạn đại diện cho động học phản ứng bậc zero và bậc 1. ).(.max 392SK Srr S + = BK TPHCM TS.LÊ HỒNG NGHIÊM30 2.4 Ảnh hưởng của nhiệt đợ đến hằng sớ tốc đơ ̣ phản ứng Sự ảnh hưởng của nhiệt đơ ̣ đến hằng sơ ́ tốc đơ ̣ phản ứng được thê ̉ hiện qua cơng thức: Trong đo ́ • kT – hằng sớ tốc đợ phản ứng, đơn vị thay đổi • A – hệ sơ ́ Van Hoff – Arrhenius, đơn vị thay đổi. • E – năng lượng hoạt hĩa, J/mol • R – hằng sớ khi ́, 8,314 J/mol.K • T – nhiệt đợ, K Cơng thức so sánh hằng sơ ́ tốc đơ ̣ phản ứng ở hai nhiệt đơ ̣ khác nhau: ).(/ 422RTET Aek −= ( ) ).(exp 43221 212 1 ⎥⎦ ⎤⎢⎣ ⎡ −⎟⎟⎠ ⎞ ⎜⎜⎝ ⎛= TT TRT E k k T T BK TPHCM TS.LÊ HỒNG NGHIÊM31 2.4 Ảnh hưởng của nhiệt đợ đến hằng sớ tốc đơ ̣ phản ứng Chú ý thêm nữa là cơng thức thơng thường thê ̉ hiện sự phu ̣ thuộc của tốc đơ ̣ phản ứng vào nhiệt đơ ̣ la ̀ E/RT1 T2 là hằng sơ ́ gần đúng, do đo ́ cơng thức trên được viết lại như sau: Trong đo ́, θ – hê ̣ sơ ́ nhiệt đơ ̣. 9Giá trị θ phụ thuộc vào điều kiện xáo trộn của nguồn nước và thường nằm trong khoảng 1,005 đến 1,030. 9 Thực tế, thường tính toán với θ = 1,024 ( ) ).( 44221 21 TT TT kk −= θ BK TPHCM TS.LÊ HỒNG NGHIÊM32 BÀI TẬP 2.6 Vận tốc phản ứng Xác định bậc của phản ứng và hằng số tốc độ phản ứng theo các số liệu thí nghiệm tiến hành trong bể phản ứng dạng mẻ cho trong bảng sau. Sử dụng cả hai phương pháp phân tích tích phân và phương pháp vi phân. Thời gian, phút CA, mol/L 0 100.0 1 50.0 2 37.0 3 28.6 4 23.3 5 19.6 6 16.9 7 15.2 8 13.3 9 12.2 10 11.1 BK TPHCM TS.LÊ HỒNG NGHIÊM33 BÀI TẬP 2.7 Vận tốc phản ứng Phản ứng phân hủy trong pha lỏng tuân theo bậc 1 được tiến hành trong bê ̉ phản ứng dạng mẻ. Phản ứng được tiến hành trong 5 giờ đê ̉ giảm nồng đợ của tác chất từ 1 mol/l xuống 0,5 mol/l. Xác định thời gian cần thiết đê ̉ giảm nồng đơ ̣ cơ chất chất xuống cịn 0,25 mol/l. BK TPHCM TS.LÊ HỒNG NGHIÊM34 BÀI TẬP 2.8 Vận tốc phản ứng Phân hủy của chất A được tiến hành trong pha lỏng với thê ̉ tıćh bế phản ứng xáo trộn liên tục thí nghiệm là 10 lít. Kết quả từ những thí nghiệm khác nhau được trình bày trong bảng sau. Xác định thời gian cần thiết để giảm nồng đơ ̣ của C từ CA0 = 1 mol/l xuống CAf = 0,4 mol/l. Bảng dữ liệu của bể khuấy liên tục ở trạng thái ổn định: CA0 , mol/l CAf , mol/l Tốc đơ ̣ dòng chảy, l/h t, h 2 2 2 1 1 1 1,2 1 0,66 0,66 0,5 0,33 15 10 5 20 10 5 0,67 1 2 0,5 1 2
File đính kèm:
 bai_giang_cac_qua_trinh_sinh_hoc_trong_ky_thuat_moi_truong_c.pdf
bai_giang_cac_qua_trinh_sinh_hoc_trong_ky_thuat_moi_truong_c.pdf

