Tổng hợp vật liệu Fe₂O₃ kích thước nanomet ứng dụng làm điện cực âm pin sạc lại
Tóm tắt:
Điện cực sắt đóng vai trò quan trọng trong pin sắt - khí. Việc làm chủ công nghệ chế tạo vật liệu điện cực này là
bước quan trọng để cải thiện dung lượng, hiệu suất phóng - nạp, và giảm giá thành của pin thương phẩm. Phương
pháp sol-gel được biết đến là một phương pháp đơn giản, dễ thực hiện để chế tạo vật liệu kích thước nanomet. Trong
nghiên cứu này, hạt nano α-Fe2O3 với các hình dạng khác nhau đã được tổng hợp bằng phương pháp sol-gel để làm
điện cực âm cho pin sắt - khí. Phép đo đặc trưng điện hóa thực hiện trên điện cực Fe2O3/AB sử dụng các vật liệu
nano Fe
2O3 tổng hợp được đã chỉ ra kích thước, hình thái học của hạt sắt ảnh hưởng mạnh đến khả năng chu trình
hóa của chúng. Tối ưu hóa quy trình chế tạo để thu được kích thước, hình dạng hạt Fe2O3 cho đặc trưng điện hóa tốt
nhất đã được thực hiện. Ảnh hưởng của chất phụ gia K2S trong dung dịch điện ly lên đặc trưng điện hóa của điện
cực Fe2O3/AB cũng được nghiên cứu.
Từ khóa: α-Fe
2O3 kích thước nanomet, phương pháp sol-gel, pin sắt - khí.
Chỉ số phân loại: 2.5

Trang 1

Trang 2

Trang 3
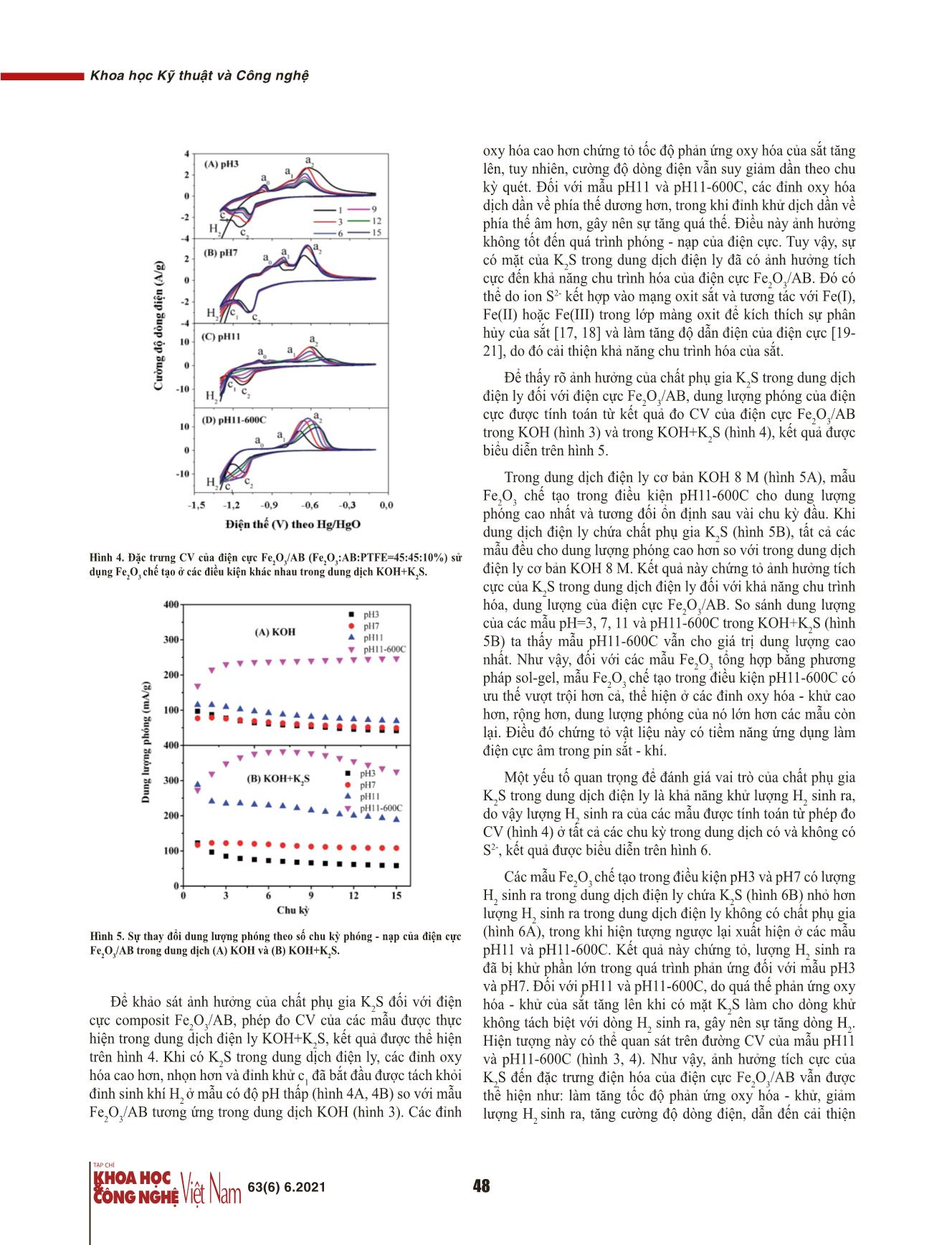
Trang 4
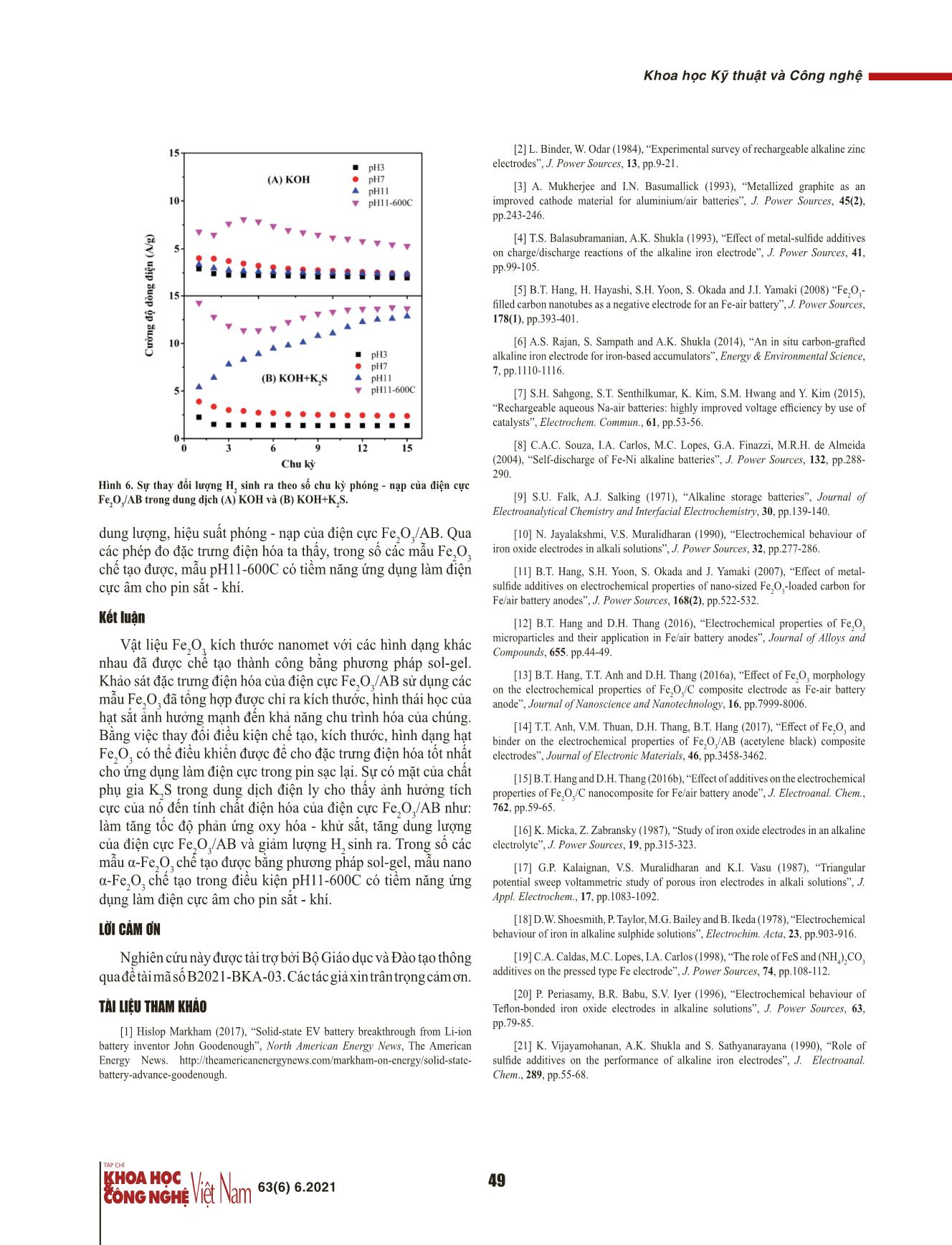
Trang 5
Tóm tắt nội dung tài liệu: Tổng hợp vật liệu Fe₂O₃ kích thước nanomet ứng dụng làm điện cực âm pin sạc lại

DOI: 10.31276/VJST.63(6).45-49 Khoa học Kỹ thuật và Công nghệ Tổng hợp vật liệu Fe2O3 kích thước nanomet ứng dụng làm điện cực âm pin sạc lại Bùi Thị Hằng*, Trần Văn Đáng, Nguyễn Văn Quy Viện Đào tạo Quốc tế về Khoa học Vật liệu, Trường Đại học Bách khoa Hà Nội Ngày nhận bài 20/4/2021; ngày chuyển phản biện 23/4/2021; ngày nhận phản biện 24/5/2021; ngày chấp nhận đăng 31/5/2021 Tóm tắt: Điện cực sắt đóng vai trò quan trọng trong pin sắt - khí. Việc làm chủ công nghệ chế tạo vật liệu điện cực này là bước quan trọng để cải thiện dung lượng, hiệu suất phóng - nạp, và giảm giá thành của pin thương phẩm. Phương pháp sol-gel được biết đến là một phương pháp đơn giản, dễ thực hiện để chế tạo vật liệu kích thước nanomet. Trong nghiên cứu này, hạt nano α-Fe2O3 với các hình dạng khác nhau đã được tổng hợp bằng phương pháp sol-gel để làm điện cực âm cho pin sắt - khí. Phép đo đặc trưng điện hóa thực hiện trên điện cực Fe2O3/AB sử dụng các vật liệu nano Fe2O3 tổng hợp được đã chỉ ra kích thước, hình thái học của hạt sắt ảnh hưởng mạnh đến khả năng chu trình hóa của chúng. Tối ưu hóa quy trình chế tạo để thu được kích thước, hình dạng hạt Fe2O3 cho đặc trưng điện hóa tốt nhất đã được thực hiện. Ảnh hưởng của chất phụ gia K2S trong dung dịch điện ly lên đặc trưng điện hóa của điện cực Fe2O3/AB cũng được nghiên cứu. Từ khóa: α-Fe2O3 kích thước nanomet, phương pháp sol-gel, pin sắt - khí. Chỉ số phân loại: 2.5 Đặt vấn đề phần các chất cấu thành điện cực cũng ảnh hưởng mạnh đến đặc trưng điện hóa của nó như hạt sắt kích thước nanomet cần Trong thời gian gần đây, xe điện đang được phát triển nhanh lượng chất kết dính nhiều hơn hạt sắt kích thước micromet. Các ở nhiều quốc gia trên thế giới, trong đó có Việt Nam. Sử dụng xe chất phụ gia cho điện cực như nano các bon và chất phụ gia cho điện thay thế các phương tiện dùng nhiên liệu hóa thạch sẽ là xu dung dịch điện ly như K S đều có tác động tích cực đến khả năng thế tất yếu trên thế giới, góp phần làm giảm tình trạng ô nhiễm môi 2 chu trình hóa của điện cực sắt, giúp cải thiện dung lượng, năng trường đang diễn ra ở nhiều quốc gia. Hiện nay, hầu hết các xe lượng, hiệu suất của pin sắt - khí [14-16]. Do vậy, việc chủ động điện đều sử dụng pin Li-ion, loại pin này có chi phí cao, không an toàn và khả năng tích trữ năng lượng của nó đã đạt mức tới hạn [1]. tạo ra vật liệu ô-xít sắt có kích thước, hình thái học phù hợp cho Vì vậy, việc phát triển một thế hệ pin mới thay thế pin Li-ion ứng ứng dụng làm điện cực âm trong pin sắt khí là rất quan trọng. dụng cho xe điện như pin kim loại - khí, pin rắn, pin kim loại - ion Phương pháp sol-gel được biết đến là một phương pháp đơn đa hóa trị đang là nhiệm vụ rất cấp bách. Trong số các loại pin giản, dễ thực hiện để chế tạo vật liệu có kích thước nanomet cho mới này, pin kim loại - khí thu hút được sự quan tâm nghiên cứu các ứng dụng khác nhau. Kế thừa, phát triển các kết quả đã đạt của đông đảo các nhà khoa học vì chúng có năng lượng lý thuyết được của các nghiên cứu trước [11-15], đồng thời với mong cao hơn, chi phí thấp hơn pin Li-ion [2, 3]. Có nhiều loại pin kim muốn góp phần làm giảm giá thành pin thương phẩm trên thị loại - khí như pin nhôm - khí, sắt - khí, kẽm - khí, Liti - khí [4-8] trường, trong công trình này, chúng tôi sử dụng phương pháp sol- nhưng pin sắt - khí được kỳ vọng hơn cả vì dung lượng lý thuyết gel để chế tạo vật liệu Fe2O3 với kích thước, hình dạng có thể điều cao, tuổi thọ dài, độ ổn định điện hóa cao, an toàn môi trường khiển cho phù hợp với ứng dụng trong pin sắt - khí nhằm cải thiện và chi phí phù hợp do sắt là nguồn vật liệu rẻ, có nhiều trên trái đất khả năng chu trình hóa của điện cực sắt. [9]. Tuy nhiên, ứng dụng thực tế của pin sắt - khí bị giới hạn bởi tính không ổn định nhiệt động lực học của sắt trong môi trường Vật liệu và phương pháp nghiên cứu kiềm [4]. Phản ứng sinh khí hydro xảy ra đồng thời với phản Muối Fe(NO3)3.9H2O (Sigma Aldrich) được sử dụng làm ứng khử Fe(OH)2 trong quá trình nạp, dẫn đến gây mất nước của nguồn sắt và axit oxalic (C2H2O4.2H2O) (Sigma Aldrich) được dung dịch điện ly cũng như làm giảm hiệu suất nạp của pin [10]. sử dụng làm phân tử phối tử (ligand molecules) trong quy trình Các kết quả nghiên cứu trước đây của nhóm nghiên cứu cho tổng hợp bột nano α-Fe2O3 bằng phương pháp sol-gel. Trước thấy kích thước, hình thái học, hàm lượng của hạt sắt ảnh hưởng tiên, muối Fe(NO3)3.9H2O và C2H2O4.2H2O được hòa tan trong mạnh đến đặc trưng điện hóa của điện cực sắt [11-13]. Cụ thể, 100 ml dung môi ethanol để tạo các dung dịch 0,1 M tương với cùng tỷ lệ các thành phần trong điện cực, hạt sắt có hình dạng ứng. Tiếp theo, nhỏ dung dịch axit vào dung dịch muối sắt khác nhau, cho các đặc trưng điện hóa khác nhau. Tỷ lệ thành đang được khuấy đều. Hỗn hợp dung dịch sau đó được duy trì *Tác giả liên hệ: Email: hang@itims.edu.vn 63(6) 6.2021 45 ... nh 3D), độ ủ mẫu không thay đổi, hạt bị kết đám nhiều hơn, kích thước các đỉnh oxy hóa - khử xuất hiện rõ ràng hơn, đỉnh khử c1 tách biệt không đồng đều, có những hạt nhỏ vài chục nanmet và những hạt với đỉnh sinh khí hyđrô và cường độ dòng oxy hóa - khử tăng theo to vài trăm nanomet. Giữ nguyên pH=11 và tăng nhiệt độ ủ mẫu số chu kỳ quét. Điều này chứng tỏ mẫu pH11-600C cho khả năng oC (hình 2D) hạt Fe O chuyển thành những mảnh từ 400 lên 600 2 3 chu trình hóa tốt hơn những mẫu còn lại. dẹt to hơn, bề mặt trơn nhẵn, kích thước từ vài chục đến vài trăm nanomet. Hạt Fe2O3 có kích thước, hình dạng khác nhau sẽ thể hiện đặc trưng điện hóa khác nhau. Nói cách khác, kích thước, hình thái học khác nhau của các mẫu Fe2O3 chế tạo ở các điều kiện khác nhau sẽ ảnh hưởng khác nhau đến đặc trưng điện hóa của chúng. Như vậy, khác nhau. Nói cách khác, kích thước, hình thái học khác nhau của các mẫu Fe2O3 chế tạo bằng ở các việc điều kiệnthay khác đổi nhaucác điều sẽ ảnh kiện hưởng chế khác tạo nhaumẫu đến bằng đặc phương trưng điện pháp hóa của chúng. Như vậy, bằng việc thay đổi các điều kiện chế tạo mẫu bằng phương pháp sol- sol-gel ta có thể thay đổi được hình dạng, kích thước của hạt Fe2O3 gel đểta có đạt th ểđược thay đđặcổi đư trưngợc hình điện dạng hóa, kích mon thưgớ cmuốn. của hạ t Fe2O3 để đạt được đặc trưng điện hóa mong muốn. (A) pH3 (B) pH7 100 nm 100 nm (C) pH11 (D) pH11-600C Hình 3. Đặc trưng CV của điện cực Fe2O3/AB (Fe2O3:AB:PTFE=45:45:10%) sử dụng Fe2O3 chế tạo ở các điều kiện khác nhau trong dung dịch KOH 8 M. So sánh đường đặc trưng CV của các mẫu Fe2O3 chế tạo được với nhau ta thấy, mẫu pH11-600C (hình 3D) cho cặp đỉnh oxy 100 nm 100 nm hóa - khử a /c cao hơn, rộng hơn các mẫu còn lại. Như vậy, cùng 2 2 một tỷ lệ thành phần Fe2O3:AB:PTFE=45:45:10%, các mẫu thể HìnhHình 2. Ảnh2. Ảnh SEM SEM của của mẫu mẫu Fe FeOO chế tạotạo ởở các các điều điều kiện kiện khác khác nhau: nhau (A): (pH3,A) pH3 (B), (B) 22 33 hiện đặc trưng điện hóa khác nhau, chứng tỏ kích thước, hình thái pH7pH7,, (C) (C) pH11 pH11 và và (D) (D) pH11 pH11-600C.-600C. học của hạt Fe O chế tạo được đã ảnh hưởng mạnh đến khả năng Đặc trưng điện hóa 2 3 Đặc trưng điện hóa chu trình hóa của sắt. Quan sát ảnh SEM của các mẫu tương ứng Kết quả đo CV của điện cực Fe2O3/AB sử dụng các mẫu Fe2O3 chế tạo bằng phương pháp sol-gel ở các điều kiện khác nhau trong dung dịch KOH 8 M được thể trên hình 2 cho thấy, mẫu pH11-600C (hình 2D) có dạng mảnh dẹt, hiện trênKết hình quả 3. Khiđo CVquét củathế theođiện chi cựcều tăngFe2O từ3/AB -1,3 đsửến dụng -0,1 V các và ngưmẫuợc Fe lại2,O đư3 ờng trong khi các mẫu khác có dạng hình cầu (hình 2A) và dạng hạt CVchế của ttạoất c ảbằng các m phươngẫu pH3 (hình pháp 3 Asol-gel), pH7 (hìnhở các 3 điềuB), pH11 kiện (hình khác 3C nhau) và pH11 trong-600C tự do (hình 2B, 2C). Các mẫu đều có kích cỡ hạt nanomet nhưng (hìnhdung 3D) dịchđều xu KOHất hiệ n8 các M đđượcỉnh oxy thể hóa hiện - kh trênử theo hình chiề u3. phóng Khi quét- nạp. thếCác theođỉnh oxy pH11-600C có kích thước hạt lớn hơn các mẫu còn lại. Điều này hóachiều xuất hi tăngện ở thtừế kho-1,3ảng đến -1,0 -0,1 V (a 0V), -và0,8 ngược V (a1) và lại, -0.6 đường V (a2) ,CV trong của khi tấtchỉ cảcó một đỉnh khử xuất hiện ở thế khoảng -1,1 V (c2) cùng với đỉnh sinh khí hyđrô theo chiều chứng tỏ, hình dạng và kích thước hạt Fe2O3 ảnh hưởng mạnh đến quétcác ngư mẫuợc lạ i.pH3 Đỉnh (hình khử s ắ3A),t Fe(II)/Fe(c pH7 (hình1) bị che 3B), ph ủpH11 hoàn toàn(hình bở i3C) đỉnh và sinh pH11- khí hyđrô khả năng chu trình hóa của nó. Trong điều kiện thí nghiệm này, (H2600C) ở các (hìnhmẫu, ngo 3D)ại tr đềuừ m ẫxuấtu pH11 hiện-600C các (hình đỉnh 3D oxy). Đỉ nhhóa a0 -xu khửất hi ệtheon do schiềuự hấp phụ nhóm OH− của điện cực sắt tạo thành Fe(OH) trước khi xảy ra phản ứng oxy hóa sắt dạng mảnh dẹt của Fe2O3 (mẫu pH11-600C) khi chế tạo điện cực phóng - nạp. Các đỉnh oxy hóa xuất adhiện ở thế khoảng -1,0 V (a ), ở đỉnh a1. Cặp đỉnh a1/c1 tương ứng với quá trình oxy hóa - khử của Fe(I)/Fe(II)0, trong Fe2O3:AB:PTFE=45:45:10% cho đường CV tốt nhất chứng tỏ hình khi -0,8cặp đ Vỉnh (a a2)/c và2 tương -0.6 Vứng (a vớ),i trongquá trình khi oxy chỉ hóa có -một khử đỉnhcủa Fe(II)/Fe(III). khử xuất hiện Đỉnh ở oxy 1 2 dạng, kích thước này của Fe2O3 là phù hợp nhất. Đó có thể do các hóathế a2 cao khoảng hơn nhi -1,1ều so V v (cới đ) ỉcùngnh a1, vớichứng đỉnh tỏ đ sinhỉnh a 2khí bao hyđrô gồm cả theo hai quá chiều trình quét oxy hóa mảnh dẹt nano Fe O có bề mặt trơn nhẵn, mỏng khi nghiền trộn Fe/Fe(II) và Fe(II)/Fe(III). Đó2 là do lớp thụ động Fe(OH)2 hình thành tại đỉnh a1 gây ra 2 3 sự tăngngược quá lại.thế Đỉnhcủa cặ pkhử phả sắtn ứ ngFe(II)/Fe(c Fe/Fe(II), d1)ẫ nbị đ cheến c ảphủ hai choànặp ph toànản ứng bởi oxy đỉnh hóa xảy với AB sẽ tạo thành điện cực có liên kết giữa các hạt Fe2O3 với ra tại đỉnh a2. Dòng điện tại các đỉnh giảm dần theo số chu kỳ quét ở các mẫu pH3 sinh khí hyđrô (H2) ở các mẫu, ngoại trừ mẫu pH11-600C (hình AB và giữa các hạt Fe2O3 với nhau chặt chẽ hơn, giúp cho quãng (hình3D). 3A ),Đỉnh pH7 (hìnha xuất 3B ),hiện pH11 do (hình sự hấp3C). phụĐáng nhóm chú ý, OHở mẫ−u của pH11 điện-600C cực (hình sắt 3 D), đường dịch chuyển của các điện tử giữa các hạt sắt thuận tiện hơn các đỉnh oxy hóa 0- khử xuất hiện rõ ràng hơn, đỉnh khử c1 tách biệt với đỉnh sinh khí hyđrôtạo và thành cường Fe(OH) độ dòngad ox trướcy hóa khi- kh ửxảy tăng ra theo phản số ứngchu k oxyỳ quét. hóa Đi ềsắtu này ở đỉnhchứng tỏ so với các mẫu khác. mẫu pH11-600C cho khả năng chu trình hóa tốt hơn những mẫu còn lại. 63(6) 6.2021 47 Khoa học Kỹ thuật và Công nghệ oxy hóa cao hơn chứng tỏ tốc độ phản ứng oxy hóa của sắt tăng lên, tuy nhiên, cường độ dòng điện vẫn suy giảm dần theo chu kỳ quét. Đối với mẫu pH11 và pH11-600C, các đỉnh oxy hóa dịch dần về phía thế dương hơn, trong khi đỉnh khử dịch dần về phía thế âm hơn, gây nên sự tăng quá thế. Điều này ảnh hưởng không tốt đến quá trình phóng - nạp của điện cực. Tuy vậy, sự có mặt của K2S trong dung dịch điện ly đã có ảnh hưởng tích cực đến khả năng chu trình hóa của điện cực Fe2O3/AB. Đó có thể do ion S2- kết hợp vào mạng oxit sắt và tương tác với Fe(I), Fe(II) hoặc Fe(III) trong lớp màng oxit để kích thích sự phân hủy của sắt [17, 18] và làm tăng độ dẫn điện của điện cực [19- 21], do đó cải thiện khả năng chu trình hóa của sắt. Để thấy rõ ảnh hưởng của chất phụ gia K2S trong dung dịch điện ly đối với điện cực Fe2O3/AB, dung lượng phóng của điện cực được tính toán từ kết quả đo CV của điện cực Fe2O3/AB trong KOH (hình 3) và trong KOH+K2S (hình 4), kết quả được biểu diễn trên hình 5. Trong dung dịch điện ly cơ bản KOH 8 M (hình 5A), mẫu Fe2O3 chế tạo trong điều kiện pH11-600C cho dung lượng phóng cao nhất và tương đối ổn định sau vài chu kỳ đầu. Khi dung dịch điện ly chứa chất phụ gia K2S (hình 5B), tất cả các Hình 4. Đặc trưng CV của điện cực Fe O /AB (Fe O :AB:PTFE=45:45:10%) sử mẫu đều cho dung lượng phóng cao hơn so với trong dung dịch 2 3 2 3 điện ly cơ bản KOH 8 M. Kết quả này chứng tỏ ảnh hưởng tích dụng Fe2O3 chế tạo ở các điều kiện khác nhau trong dung dịch KOH+K2S. cực của K2S trong dung dịch điện ly đối với khả năng chu trình hóa, dung lượng của điện cực Fe2O3/AB. So sánh dung lượng của các mẫu pH=3, 7, 11 và pH11-600C trong KOH+K2S (hình 5B) ta thấy mẫu pH11-600C vẫn cho giá trị dung lượng cao nhất. Như vậy, đối với các mẫu Fe2O3 tổng hợp bằng phương pháp sol-gel, mẫu Fe2O3 chế tạo trong điều kiện pH11-600C có ưu thế vượt trội hơn cả, thể hiện ở các đỉnh oxy hóa - khử cao hơn, rộng hơn, dung lượng phóng của nó lớn hơn các mẫu còn lại. Điều đó chứng tỏ vật liệu này có tiềm năng ứng dụng làm điện cực âm trong pin sắt - khí. Một yếu tố quan trọng để đánh giá vai trò của chất phụ gia K2S trong dung dịch điện ly là khả năng khử lượng H2 sinh ra, do vậy lượng H2 sinh ra của các mẫu được tính toán từ phép đo CV (hình 4) ở tất cả các chu kỳ trong dung dịch có và không có S2-, kết quả được biểu diễn trên hình 6. Các mẫu Fe2O3 chế tạo trong điều kiện pH3 và pH7 có lượng H2 sinh ra trong dung dịch điện ly chứa K2S (hình 6B) nhỏ hơn lượng H2 sinh ra trong dung dịch điện ly không có chất phụ gia Hình 5. Sự thay đổi dung lượng phóng theo số chu kỳ phóng - nạp của điện cực (hình 6A), trong khi hiện tượng ngược lại xuất hiện ở các mẫu Fe2O3/AB trong dung dịch (A) KOH và (B) KOH+K2S. pH11 và pH11-600C. Kết quả này chứng tỏ, lượng H2 sinh ra đã bị khử phần lớn trong quá trình phản ứng đối với mẫu pH3 và pH7. Đối với pH11 và pH11-600C, do quá thế phản ứng oxy Để khảo sát ảnh hưởng của chất phụ gia K S đối với điện 2 hóa - khử của sắt tăng lên khi có mặt K2S làm cho dòng khử cực composit Fe O /AB, phép đo CV của các mẫu được thực 2 3 không tách biệt với dòng H2 sinh ra, gây nên sự tăng dòng H2. hiện trong dung dịch điện ly KOH+K2S, kết quả được thể hiện Hiện tượng này có thể quan sát trên đường CV của mẫu pH11 trên hình 4. Khi có K2S trong dung dịch điện ly, các đỉnh oxy và pH11-600C (hình 3, 4). Như vậy, ảnh hưởng tích cực của hóa cao hơn, nhọn hơn và đỉnh khử c đã bắt đầu được tách khỏi 1 K2S đến đặc trưng điện hóa của điện cực Fe2O3/AB vẫn được đỉnh sinh khí H2 ở mẫu có độ pH thấp (hình 4A, 4B) so với mẫu thể hiện như: làm tăng tốc độ phản ứng oxy hóa - khử, giảm Fe O /AB tương ứng trong dung dịch KOH (hình 3). Các đỉnh 2 3 lượng H2 sinh ra, tăng cường độ dòng điện, dẫn đến cải thiện 63(6) 6.2021 48 Khoa học Kỹ thuật và Công nghệ [2] L. Binder, W. Odar (1984), “Experimental survey of rechargeable alkaline zinc electrodes”, J. Power Sources, 13, pp.9-21. [3] A. Mukherjee and I.N. Basumallick (1993), “Metallized graphite as an improved cathode material for aluminium/air batteries”, J. Power Sources, 45(2), pp.243-246. [4] T.S. Balasubramanian, A.K. Shukla (1993), “Effect of metal-sulfide additives on charge/discharge reactions of the alkaline iron electrode”, J. Power Sources, 41, pp.99-105. [5] B.T. Hang, H. Hayashi, S.H. Yoon, S. Okada and J.I. Yamaki (2008) “Fe2O3- filled carbon nanotubes as a negative electrode for an Fe-air battery”,J. Power Sources, 178(1), pp.393-401. [6] A.S. Rajan, S. Sampath and A.K. Shukla (2014), “An in situ carbon-grafted alkaline iron electrode for iron-based accumulators”, Energy & Environmental Science, 7, pp.1110-1116. [7] S.H. Sahgong, S.T. Senthilkumar, K. Kim, S.M. Hwang and Y. Kim (2015), “Rechargeable aqueous Na-air batteries: highly improved voltage efficiency by use of catalysts”, Electrochem. Commun., 61, pp.53-56. [8] C.A.C. Souza, I.A. Carlos, M.C. Lopes, G.A. Finazzi, M.R.H. de Almeida (2004), “Self-discharge of Fe-Ni alkaline batteries”, J. Power Sources, 132, pp.288- 290. Hình 6. Sự thay đổi lượng H2 sinh ra theo số chu kỳ phóng - nạp của điện cực [9] S.U. Falk, A.J. Salking (1971), “Alkaline storage batteries”, Journal of Fe2O3/AB trong dung dịch (A) KOH và (B) KOH+K2S. Electroanalytical Chemistry and Interfacial Electrochemistry, 30, pp.139-140. dung lượng, hiệu suất phóng - nạp của điện cực Fe2O3/AB. Qua [10] N. Jayalakshmi, V.S. Muralidharan (1990), “Electrochemical behaviour of iron oxide electrodes in alkali solutions”, J. Power Sources, 32, pp.277-286. các phép đo đặc trưng điện hóa ta thấy, trong số các mẫu Fe2O3 chế tạo được, mẫu pH11-600C có tiềm năng ứng dụng làm điện [11] B.T. Hang, S.H. Yoon, S. Okada and J. Yamaki (2007), “Effect of metal- cực âm cho pin sắt - khí. sulfide additives on electrochemical properties of nano-sized Fe2O3-loaded carbon for Fe/air battery anodes”, J. Power Sources, 168(2), pp.522-532. Kết luận [12] B.T. Hang and D.H. Thang (2016), “Electrochemical properties of Fe2O3 microparticles and their application in Fe/air battery anodes”, Journal of Alloys and Vật liệu Fe2O3 kích thước nanomet với các hình dạng khác Compounds, 655. pp.44-49. nhau đã được chế tạo thành công bằng phương pháp sol-gel. [13] B.T. Hang, T.T. Anh and D.H. Thang (2016a), “Effect of Fe2O3 morphology Khảo sát đặc trưng điện hóa của điện cực Fe2O3/AB sử dụng các on the electrochemical properties of Fe2O3/C composite electrode as Fe-air battery mẫu Fe2O3 đã tổng hợp được chỉ ra kích thước, hình thái học của anode”, Journal of Nanoscience and Nanotechnology, 16, pp.7999-8006. hạt sắt ảnh hưởng mạnh đến khả năng chu trình hóa của chúng. [14] T.T. Anh, V.M. Thuan, D.H. Thang, B.T. Hang (2017), “Effect of Fe O and Bằng việc thay đổi điều kiện chế tạo, kích thước, hình dạng hạt 2 3 binder on the electrochemical properties of Fe2O3/AB (acetylene black) composite Fe2O3 có thể điều khiển được để cho đặc trưng điện hóa tốt nhất electrodes”, Journal of Electronic Materials, 46, pp.3458-3462. cho ứng dụng làm điện cực trong pin sạc lại. Sự có mặt của chất [15] B.T. Hang and D.H. Thang (2016b), “Effect of additives on the electrochemical phụ gia K2S trong dung dịch điện ly cho thấy ảnh hưởng tích properties of Fe2O3/C nanocomposite for Fe/air battery anode”, J. Electroanal. Chem., 762, pp.59-65. cực của nó đến tính chất điện hóa của điện cực Fe2O3/AB như: làm tăng tốc độ phản ứng oxy hóa - khử sắt, tăng dung lượng [16] K. Micka, Z. Zabransky (1987), “Study of iron oxide electrodes in an alkaline electrolyte”, J. Power Sources, 19, pp.315-323. của điện cực Fe2O3/AB và giảm lượng H2 sinh ra. Trong số các mẫu α-Fe2O3 chế tạo được bằng phương pháp sol-gel, mẫu nano [17] G.P. Kalaignan, V.S. Muralidharan and K.I. Vasu (1987), “Triangular α-Fe2O3 chế tạo trong điều kiện pH11-600C có tiềm năng ứng potential sweep voltammetric study of porous iron electrodes in alkali solutions”, J. dụng làm điện cực âm cho pin sắt - khí. Appl. Electrochem., 17, pp.1083-1092. [18] D.W. Shoesmith, P. Taylor, M.G. Bailey and B. Ikeda (1978), “Electrochemical LỜI CẢM ƠN behaviour of iron in alkaline sulphide solutions”, Electrochim. Acta, 23, pp.903-916. Nghiên cứu này được tài trợ bởi Bộ Giáo dục và Đào tạo thông [19] C.A. Caldas, M.C. Lopes, I.A. Carlos (1998), “The role of FeS and (NH4)2CO3 qua đề tài mã số B2021-BKA-03. Các tác giả xin trân trọng cảm ơn. additives on the pressed type Fe electrode”, J. Power Sources, 74, pp.108-112. [20] P. Periasamy, B.R. Babu, S.V. Iyer (1996), “Electrochemical behaviour of TÀI LIỆU THAM KHẢO Teflon-bonded iron oxide electrodes in alkaline solutions”, J. Power Sources, 63, pp.79-85. [1] Hislop Markham (2017), “Solid-state EV battery breakthrough from Li-ion battery inventor John Goodenough”, North American Energy News, The American [21] K. Vijayamohanan, A.K. Shukla and S. Sathyanarayana (1990), “Role of Energy News. sulfide additives on the performance of alkaline iron electrodes”, J. Electroanal. battery-advance-goodenough. Chem., 289, pp.55-68. 63(6) 6.2021 49
File đính kèm:
 tong_hop_vat_lieu_feo_kich_thuoc_nanomet_ung_dung_lam_dien_c.pdf
tong_hop_vat_lieu_feo_kich_thuoc_nanomet_ung_dung_lam_dien_c.pdf

