Tín hiệu Von-Ampe hòa tan anot xung vi phân của thủy ngân trên điện cực than thủy tinh phủ màng vàng
Thủy ngân là kim loại tồn tại dạng lỏng ở nhiệt độ thường. Thủy ngân là
nguyên tố có độc tính cao, có khả năng tích lũy sinh học, có thể bị hấp thụ qua da
người, các cơ quan hô hấp và tiêu hóa. Khi đi vào môi trường, do hoạt động của vi sinh
vật, thủy ngân dễ bị chuyển hóa thành dạng metyl thủy ngân có độc tính cao hơn các
dạng hợp chất thủy ngân vô cơ. Khi đi vào chuỗi thức ăn thủy ngân gây ảnh hưởng
nghiêm trọng đối với sức khỏe con người và các loài động vật khác [1, 2, 3, 4].
Ở Việt Nam, tại các khu vực khai thác vàng tự phát, người dân đã sử dụng một
lượng lớn thủy ngân để tách vàng sa khoáng. Hoạt động này đã đưa một lượng thủy
ngân đáng kể vào các vực nước mặt ở khu vực đầu nguồn, gây nguy cơ ô nhiễm nước
ở vùng hạ du. Vì vậy, quan trắc kiểm soát tình trạng ô nhiễm thủy ngân trong các
nguồn nước là một nhu cầu cấp thiết. Các phương pháp quang phổ thường được dùng
để xác định lượng vết thủy ngân như: quang phổ huỳnh quang nguyên tử hóa hơi lạnh
(CV-AFS); quang phổ hấp thụ nguyên tử hóa hơi lạnh (CV-AAS); khối phổ plasma
(ICP-MS). Những phương pháp này có độ nhạy cao, giới hạn phát hiện thấp.

Trang 1

Trang 2

Trang 3
Trang 4

Trang 5

Trang 6
Trang 7
Trang 8

Trang 9

Trang 10
Tóm tắt nội dung tài liệu: Tín hiệu Von-Ampe hòa tan anot xung vi phân của thủy ngân trên điện cực than thủy tinh phủ màng vàng

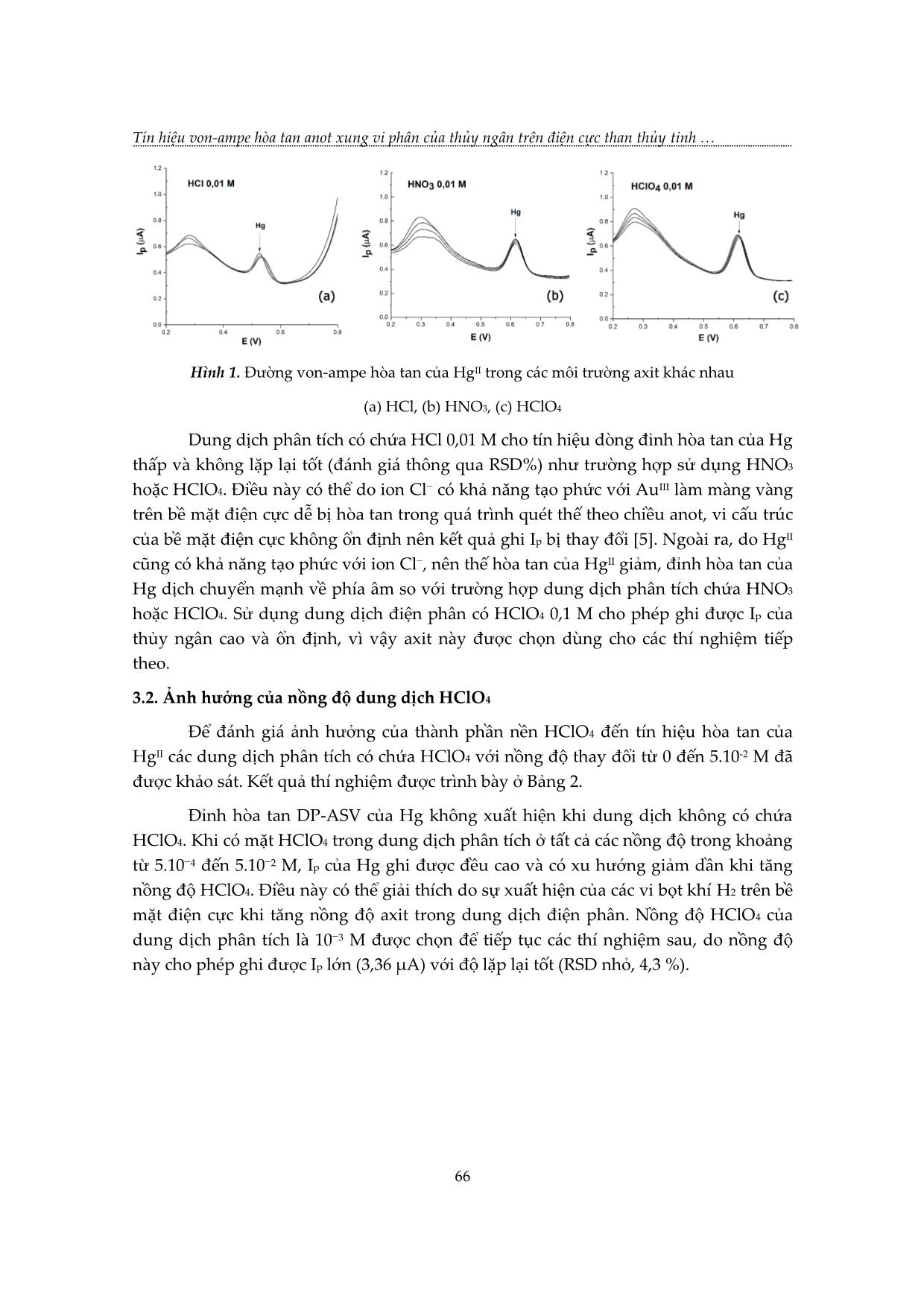
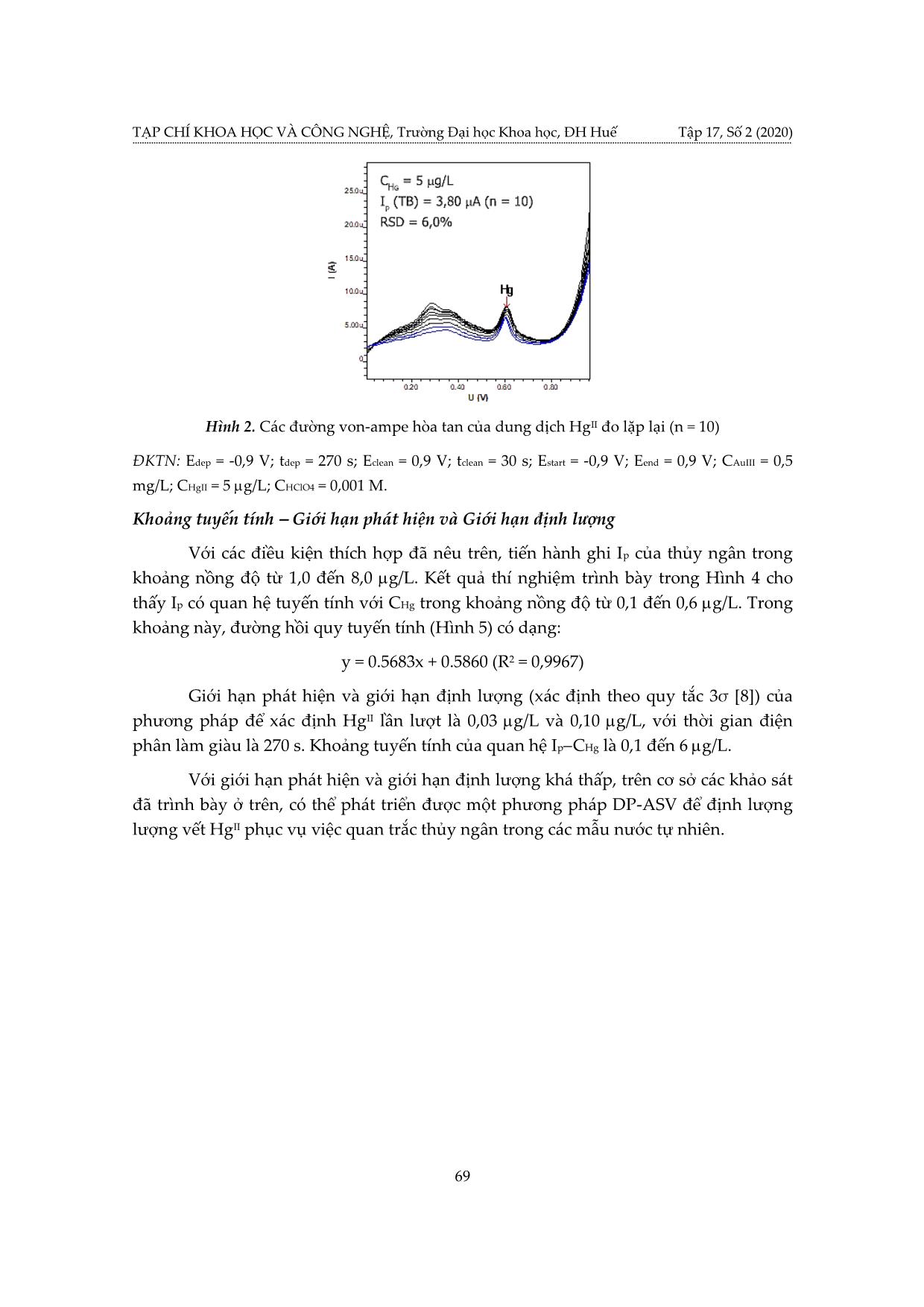
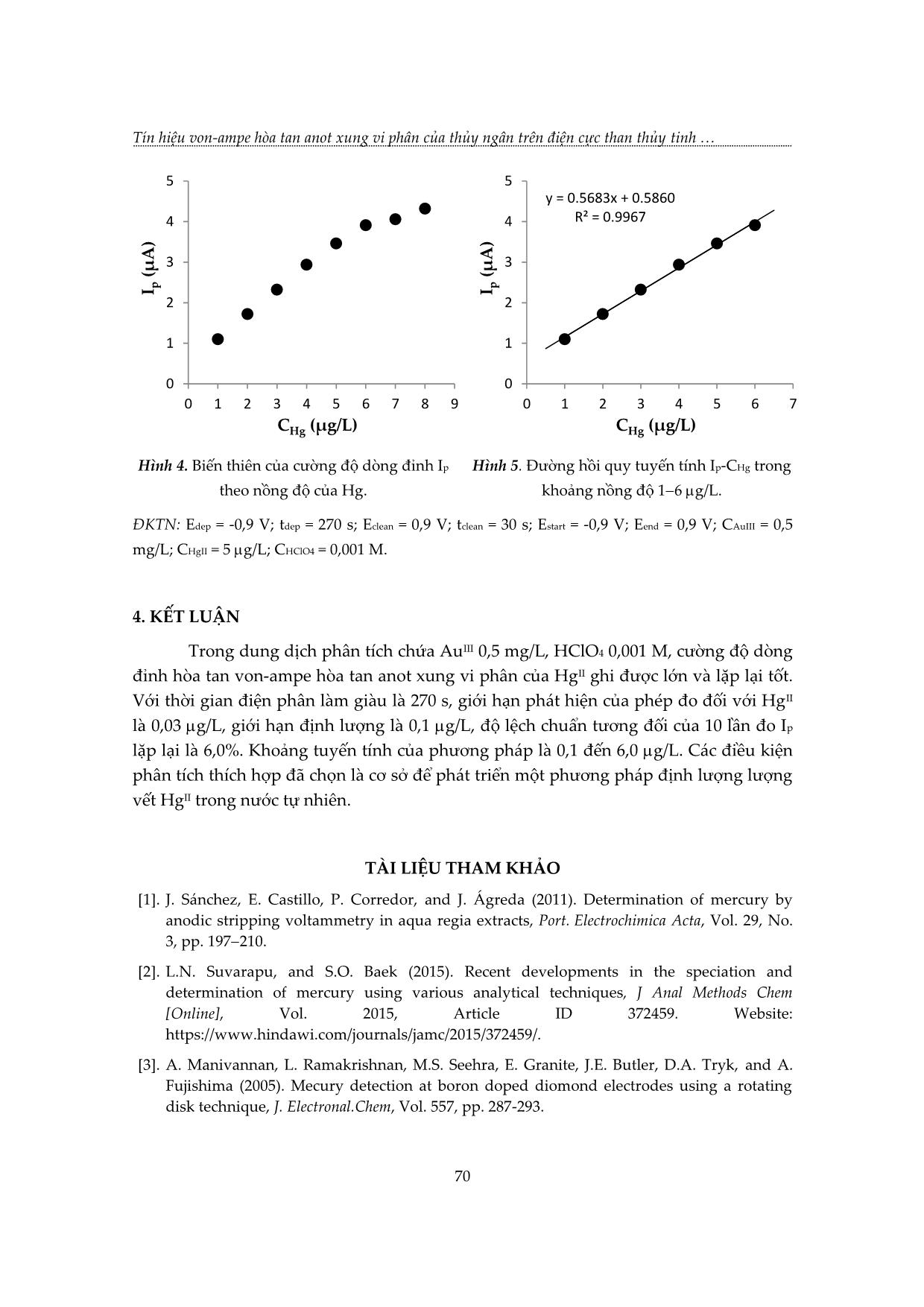
TẠP CHÍ KHOA HỌC VÀ CÔNG NGHỆ, Trường Đại học Khoa học, ĐH Huế Tập 17, Số 2 (2020) TÍN HIỆU VON-AMPE HÒA TAN ANOT XUNG VI PHÂN CỦA THỦY NGÂN TRÊN ĐIỆN CỰC THAN THỦY TINH PHỦ MÀNG VÀNG Nguyễn Thị Nhi Phương1,2, Nguyễn Văn Hợp2, Hoàng Thái Long2* 1 Khoa Hóa – Sinh – Môi trường, Trường Đại học Phạm Văn Đồng, Quảng Ngãi 2 Khoa Hóa học, Trường Đại học Khoa học, Đại học Huế * Email: hthailong@hueuni.edu.vn Ngày nhận bài: 17/6/2020; ngày hoàn thành phản biện: 7/8/2020; ngày duyệt đăng: 02/10/2020 TÓM TẮT Các yếu tố ảnh hưởng đến tín hiệu dòng đỉnh hòa tan von-ampe xung vi phân (DP-ASV) của thủy ngân đã được khảo sát trên điện cực than thủy tính biến tính bằng màng vàng với kỹ thuật in situ. Trong dung dịch phân tích chứa AuIII 0,5 mg/L, HClO4 0,001 M, cường độ dòng đỉnh hòa tan của HgII ghi được lớn và lặp lại tốt. Với thời gian điện phân làm giàu là 270 s, giới hạn phát hiện của phép đo đối với HgII là 0,03 g/L, độ lệch chuẩn tương đối của 10 lần đo Ip lặp lại là 6,0 %. Khoảng tuyến tính của phương pháp là 0,1 đến 6,0 g/L. Từ khóa: Hg, màng vàng, than thủy tinh, thủy ngân, von-ampe hòa tan anot. 1. MỞ ĐẦU Thủy ngân là kim loại tồn tại dạng lỏng ở nhiệt độ thường. Thủy ngân là nguyên tố có độc tính cao, có khả năng tích lũy sinh học, có thể bị hấp thụ qua da người, các cơ quan hô hấp và tiêu hóa. Khi đi vào môi trường, do hoạt động của vi sinh vật, thủy ngân dễ bị chuyển hóa thành dạng metyl thủy ngân có độc tính cao hơn các dạng hợp chất thủy ngân vô cơ. Khi đi vào chuỗi thức ăn thủy ngân gây ảnh hưởng nghiêm trọng đối với sức khỏe con người và các loài động vật khác [1, 2, 3, 4]. Ở Việt Nam, tại các khu vực khai thác vàng tự phát, người dân đã sử dụng một lượng lớn thủy ngân để tách vàng sa khoáng. Hoạt động này đã đưa một lượng thủy ngân đáng kể vào các vực nước mặt ở khu vực đầu nguồn, gây nguy cơ ô nhiễm nước ở vùng hạ du. Vì vậy, quan trắc kiểm soát tình trạng ô nhiễm thủy ngân trong các nguồn nước là một nhu cầu cấp thiết. Các phương pháp quang phổ thường được dùng để xác định lượng vết thủy ngân như: quang phổ huỳnh quang nguyên tử hóa hơi lạnh (CV-AFS); quang phổ hấp thụ nguyên tử hóa hơi lạnh (CV-AAS); khối phổ plasma (ICP-MS)... Những phương pháp này có độ nhạy cao, giới hạn phát hiện thấp. Tuy 63 Tín hiệu von-ampe hòa tan anot xung vi phân của thủy ngân trên điện cực than thủy tinh nhiên, chúng yêu cầu kỹ thuật chuẩn bị mẫu phức tạp, thiết bị đắt tiền và dẫn đến chi phí cao [3, 5, 6]. Kết quả của nhiều nghiên cứu cho thấy rằng, có thể xác định thủy ngân bằng phương pháp von-ampe hòa tan anot [3, 5]. Do vàng có thể tạo hỗn hống với thủy ngân nên các điện cực nền phủ/biến tính bằng màng vàng sẽ tạo điều kiện tốt cho quá trình làm giàu Hg, làm tăng độ nhạy, hạn chế sự tạo thành kết tủa khó tan Hg2Cl2 trên bề mặt điện cực làm giảm độ lặp lại của phép phân tích [3, 5]. Nghiên cứu này tập trung khảo sát, lựa chọn các điều kiện thích hợp để có thể ghi được tín hiệu von-ampe hòa tan của Hg nhạy và lặp lại tốt trên điện cực than thủy tinh phủ màng vàng (GC-AuFE). 2. THỰC NGHIỆM 2.1. Hóa chất, thiết bị Các dung dịch chuẩn HgII được pha chế từ dung dịch chuẩn gốc HgII 1000 mg/L trong HNO3 2 M chuyên dụng cho phân tích quang phổ hấp thụ nguyên tử (Merck, Đức). Dung dịch AuIII được chuẩn bị bằng cách hòa tan HAuCl4.3H2O (Merck) trong dung dịch HCl 0,1 M. Tất cả các hóa chất được sử dụng khác đều là hóa chất tinh khiết dùng cho phân tích của hãng Merck. Nước cất 2 lần được dùng để chuẩn bị dung dịch. Tất cả dụng cụ thủy tinh được làm sạch bằng cách ngâm trong dung dịch HNO3 1:2 (v:v) trong 4−6 giờ, sau đó tráng bằng nước cất trước khi sử dụng. Các thí nghiệm phân tích được tiến hành trên thiết bị Metrohm 797 VA Computrace (Thụy Sỹ) với hệ 3 điện cực (điện cực làm việc là điện cực rắn đĩa quay than thủy tinh, điện cực so sánh Ag/AgCl, điện cực phụ trợ Pt). Thiết bị được điều khiển bằng phần mềm 797 VA Computrace. 2.2. Chuẩn bị điện cực than thủy tinh Điện cực nền là điện cực than thủy tinh (glassy carbon, GC) tự chế tạo từ thanh than thủy tinh đường kính 3 mm (SPI-Glas™ 11 Brand glassy carbon, SPI supplies, Hoa Kỳ) và nhựa Teflon. Điện cực GC được mài bóng với hỗn hợp nhão chứa bột Al2O3 chuyên dụng (kích thước hạt 0,6 m) và nước cất. Rửa điện cực bằng nước cất; sau đó ngâm trong dung dịch HNO3 2 M; rửa lại nhiều lần bằng nước cất 2 lần, để khô tự nhiên ở nhiệt độ phòng. 2.3. Điện phân tạo màng Au và ghi tín hiệu ASV của HgII Các điện cực màng vàng (GC-AuFE) dùng trong nghiên cứu này đều được chế tạo bằng kỹ thuật điện phân in situ. Nhúng điện cực than thủy tinh đã đánh bóng và làm sạch, điện cực so sánh và điện cực đối vào bình điện phân. Dung dịch phân tích trong bình điện phân chứa HClO4, AuIII và HgII. Tiến hành điện phân làm giàu ở thế 64 TẠP CHÍ KHOA HỌC VÀ CÔNG NGHỆ, Trường Đại học Khoa học, ĐH Huế Tập 17, Số 2 (2020) (Edep) trong thời gian ... I sẽ bị khử thành kim loại bám trên bề mặt điện cực than thủy tinh để tạo thành lớp màng vàng rất mỏng. Đồng thời với quá trình tạo màng, trong giai đoạn này HgII sẽ bị khử về Hg kim loại tập trung lên bề mặt điện cực và tạo hỗn hống với Au. Kết thúc giai đoạn tạo màng và làm giàu, ngừng khuấy điện cực 5–15 s (thời gian cân bằng tequal). Sau đó, quét thế theo chiều dương dần từ Estart đến Eend, đồng thời ghi đường von-ampe hòa tan theo kỹ thuật xung vi phân (DP-ASV) với các thông số kỹ thuật thích hợp. Sau mỗi chu kỳ quét thế, điện cực được làm sạch điện hóa ở thế Eclean trong một khoảng thời gian tclean thích hợp, lúc này lớp màng vàng được hòa tan và bị bóc khỏi bề mặt điện cực nền than thủy tinh. Cuối cùng, xác định thế và cường độ dòng đỉnh hòa tan (Ep, Ip) của HgII từ đường von-ampe hòa tan xung vi phân thu được. Cường độ dòng đỉnh hòa tan Ip là tín hiệu dùng để phân tích định lượng HgII trong dung dịch. 3. KẾT QUẢ VÀ THẢO LUẬN 3.1. Ảnh hưởng của môi trường điện phân Tín hiệu von-ampe hòa tan của thủy ngân trên bề mặt vàng bị ảnh hưởng mạnh bởi môi trường điện phân. Các dung dịch HCl, HNO3 và HClO4 cùng có nồng độ 0,01 M đã được thử nghiệm để làm rõ ảnh hưởng của chúng lên độ nhạy và độ lặp lại của tín hiệu DP-ASV của thủy ngân. Kết quả thí nghiệm được trình bày ở Bảng 1 và Hình 1. Bảng 1. Ảnh hưởng của loại axit trong dung dịch điện phân đến Ip của Hg Loại axit (0,01 M) IP trung bình (μA, n = 4) RSD (%, n = 4) HCl 1,670 5,7 HNO3 2,568 2,1 HClO4 3,907 2,1 Điều kiện thí nghiệm (ĐKTN): Edep = -0,9 V; tdep = 300 s; Eclean = 0,9 V; tclean = 30 s; Estart = -0,9 V; Eend = 0,9 V; CAuIII = 0,5 mg/L; CHgII = 5 g/L. ( )RSD: Độ lệch chuẩn tương đối (Relative standard deviation). Khi dung dịch điện phân không có chứa axit thì đỉnh hòa tan của Hg không xuất hiện, đồng thời đường von-ampe hòa tan cũng có nền bị nhiễu mạnh. 65 Tín hiệu von-ampe hòa tan anot xung vi phân của thủy ngân trên điện cực than thủy tinh Hình 1. Đường von-ampe hòa tan của HgII trong các môi trường axit khác nhau (a) HCl, (b) HNO3, (c) HClO4 Dung dịch phân tích có chứa HCl 0,01 M cho tín hiệu dòng đỉnh hòa tan của Hg thấp và không lặp lại tốt (đánh giá thông qua RSD%) như trường hợp sử dụng HNO3 − hoặc HClO4. Điều này có thể do ion Cl có khả năng tạo phức với AuIII làm màng vàng trên bề mặt điện cực dễ bị hòa tan trong quá trình quét thế theo chiều anot, vi cấu trúc của bề mặt điện cực không ổn định nên kết quả ghi Ip bị thay đổi [5]. Ngoài ra, do HgII cũng có khả năng tạo phức với ion Cl−, nên thế hòa tan của HgII giảm, đỉnh hòa tan của Hg dịch chuyển mạnh về phía âm so với trường hợp dung dịch phân tích chứa HNO3 hoặc HClO4. Sử dụng dung dịch điện phân có HClO4 0,1 M cho phép ghi được Ip của thủy ngân cao và ổn định, vì vậy axit này được chọn dùng cho các thí nghiệm tiếp theo. 3.2. Ảnh hưởng của nồng độ dung dịch HClO4 Để đánh giá ảnh hưởng của thành phần nền HClO4 đến tín hiệu hòa tan của HgII các dung dịch phân tích có chứa HClO4 với nồng độ thay đổi từ 0 đến 5.10-2 M đã được khảo sát. Kết quả thí nghiệm được trình bày ở Bảng 2. Đỉnh hòa tan DP-ASV của Hg không xuất hiện khi dung dịch không có chứa HClO4. Khi có mặt HClO4 trong dung dịch phân tích ở tất cả các nồng độ trong khoảng − − từ 5.10 4 đến 5.10 2 M, Ip của Hg ghi được đều cao và có xu hướng giảm dần khi tăng nồng độ HClO4. Điều này có thể giải thích do sự xuất hiện của các vi bọt khí H2 trên bề mặt điện cực khi tăng nồng độ axit trong dung dịch điện phân. Nồng độ HClO4 của dung dịch phân tích là 10−3 M được chọn để tiếp tục các thí nghiệm sau, do nồng độ này cho phép ghi được Ip lớn (3,36 µA) với độ lặp lại tốt (RSD nhỏ, 4,3 %). 66 TẠP CHÍ KHOA HỌC VÀ CÔNG NGHỆ, Trường Đại học Khoa học, ĐH Huế Tập 17, Số 2 (2020) Bảng 2. Ảnh hưởng của nồng độ HClO4 đến Ip của Hg Nồng độ HClO4 (M) Thông số 0 5.10-4 10-3 5.10-3 10-2 5.10-2 Ip (A) − 4,18 3,36 3,43 3,17 2,76 RSD (%, n = 10) − 12,7 4,3 5,3 9,4 6,7 “−”: không xuất hiện đỉnh hòa tan của Hg. ĐKTN: Edep = -0,9 V; tdep = 300 s; Eclean = 0,9 V; tclean = 30 s; Estart = -0,9 V; Eend = 0,9 V; CAuIII = 0,5 mg/L; CHgII = 5 g/L. 3.3. Ảnh hưởng của nồng độ dung dịch AuIII Như đã nêu trên, sự có mặt của AuIII trong dung dịch đóng một vai trò rất quan trọng trong quá trình phân tích HgII bằng phương pháp von-ampe hòa tan. Trong quá trình điện phân làm giàu, AuIII chuyển thành Au0. Au0 sẽ bám vào bề mặt điện cực tạo ra hỗn hống với Hg0, hạn chế sự tạo thành kết tủa khó tan Hg2Cl2. Để khảo sát ảnh hưởng của nồng độ AuIII đến tín hiệu hòa tan của HgII, tiến hành ghi Ip của dung dịch − chứa HgII 5 g/L, HClO4 10 3 M, nồng độ AuIII tăng dần từ 0,1 đến 0,5 mg/L. Bảng 3. Ảnh hưởng của nồng độ AuIII đến Ip của Hg Nồng độ AuIII (mg/L) Thông số 0,1 0,2 0,3 0,4 0,5 Ip (µA) − 3,19 2,86 3,19 3,49 RSD (%, n = 10) − 4,7 6,3 7,2 3,8 “−”: không xuất hiện đỉnh hòa tan của Hg. ĐKTN: Edep = -0,9 V; tdep = 300 s; Eclean = 0,9 V; tclean = 30 s; Estart = -0,9 V; Eend = 0,9 V; CHgII = 5 g/L; CHClO4 = 0,001 M. Khi CAuIII = 0,1 mg/L, màng Au tạo thành trên bề mặt điện cực quá mỏng không thuận lợi cho quá trình làm giàu Hg, thực tế không ghi được đỉnh hòa tan của Hg. Độ lặp lại của Ip khá tốt khi tăng nồng độ AuIII trong dung dịch phân tích đến 0,5 mg/L (Ip = 3,49 A; RSD = 3,8 %; n = 10). Với mục đích giảm chi phí phân tích, không tiến hành khảo sát ảnh hưởng của nồng độ AuIII ở các mức cao hơn 0,5 mg/L. Chọn nồng độ của AuIII là 0,5 mg/L để tiến hành các thí nghiệm tiếp theo. 3.4. Ảnh hưởng của thế và thời gian điện phân làm giàu Thế điện phân làm giàu (Edep) Trong giai đoạn làm giàu khi áp vào điện cực một thế đủ âm, HgII sẽ bị khử về Hg kim loại, quá trình này được gọi là quá trình làm giàu. Hg kim loại sẽ tạo hỗn hống với Au kim loại và được giữ lại trên bề mặt điện cực làm việc. Khoảng thế điện phân làm giàu được khảo sát từ -0,7 đến -1,1 V (Bảng 4). 67 Tín hiệu von-ampe hòa tan anot xung vi phân của thủy ngân trên điện cực than thủy tinh Thế điện phân có thể ảnh hưởng đến vi cấu trúc của lớp màng vàng in situ hình thành trên điện cực than thủy tinh cũng như hiệu quả của quá trình làm giàu của Hg trên bề mặt điện cực. Điều đó có thể ảnh hưởng đến cường độ dòng đỉnh cũng như độ lặp lại của kết quả ghi Ip. Giá trị Ip tăng dần khi thế điện phân âm dần. Khi Edep = -1,1 V, Ip đạt giá trị cực đại, nhưng độ lặp lại không cao. Khi Edep = -0,9 V, Ip đạt giá trị tương đối lớn và độ lặp lại của kết quả tốt nên thế điện phân này được chọn để khảo sát điều kiện phân tích định lượng Hg bằng phương pháp DP-ASV đang nghiên cứu. Bảng 4. Ảnh hưởng của thế điện phân (Edep) làm giàu đến Ip của Hg Edep (V) -0,7 -0,8 -0,9 -1,0 -1,1 Ip (TB) (µA) 2,32 2,16 2,31 2,99 3,23 RSD (%, n = 10) 10,2 10,5 5,9 8,2 12,5 ĐKTN: tdep = 300 s; Eclean = 0,9 V; tclean = 30 s; Estart = -0,9 V; Eend = 0,9 V; CAuIII = 0,5 mg/L; CHgII = 5 g/L; CHClO4 = 0,001 M. Thời gian điện phân làm giàu (tdep) Cường độ dòng đỉnh hòa tan phụ thuộc nhiều vào thời gian điện phân làm giàu. Khi tăng thời gian điện phân làm giàu thì Ip tăng. Tuy vậy, khi tăng thời gian làm giàu quá lớn, bề mặt điện cực có xu thế bão hòa chất phân tích, Ip tăng không đáng kể. Bảng 5. Ảnh hưởng của thời gian điện phân làm giàu đến Ip của Hg tdep (s) 210 240 270 300 330 360 Ip (TB) (µA) 3,03 3,38 2,90 5,50 4,40 4,32 RSD (%, n = 10) 5,7 5,7 4,0 4,7 8,6 14,3 ĐKTN: Edep = -0,9 V; Eclean = 0,9 V; tclean = 30 s; Estart = -0,9 V; Eend = 0,9 V; CAuIII = 0,5 mg/L; CHgII = 5 g/L; CHClO4 = 0,001 M. Để xác định được thời gian điện phân làm giàu thích hợp đã tiến hành ghi Ip ở các thời gian điện phân tăng dần từ 210 s đến 360 s. Với tdep trong khoảng từ 330 s đến 360 s, Ip và cả độ lặp lại giảm dần. Chọn tdep = 270 s để tiết kiệm thời gian phân tích vì tại thế làm giàu này Ip cũng đã đủ lớn để có thể định lượng lượng vết Hg (Bảng 5). 3.5. Độ lặp lại, khoảng tuyến tính và giới hạn phát hiện Độ lặp lại Ghi Ip của dung dịch HgII 5 g/L lặp lại 10 lần (Hình 2). Giá trị RSD tính được từ 10 kết quả đo lặp lại là 6,0%, nhỏ hơn nhiều giá trị độ lệch chuẩn phòng thí nghiệm (½ RSDR) tính theo hàm Horwitz [7] là 17,76%, do đó kết quả ghi Ip có độ lặp lại tốt. 68 TẠP CHÍ KHOA HỌC VÀ CÔNG NGHỆ, Trường Đại học Khoa học, ĐH Huế Tập 17, Số 2 (2020) Hình 2. Các đường von-ampe hòa tan của dung dịch HgII đo lặp lại (n = 10) ĐKTN: Edep = -0,9 V; tdep = 270 s; Eclean = 0,9 V; tclean = 30 s; Estart = -0,9 V; Eend = 0,9 V; CAuIII = 0,5 mg/L; CHgII = 5 g/L; CHClO4 = 0,001 M. Khoảng tuyến tính − Giới hạn phát hiện và Giới hạn định lượng Với các điều kiện thích hợp đã nêu trên, tiến hành ghi Ip của thủy ngân trong khoảng nồng độ từ 1,0 đến 8,0 g/L. Kết quả thí nghiệm trình bày trong Hình 4 cho thấy Ip có quan hệ tuyến tính với CHg trong khoảng nồng độ từ 0,1 đến 0,6 g/L. Trong khoảng này, đường hồi quy tuyến tính (Hình 5) có dạng: y = 0.5683x + 0.5860 (R2 = 0,9967) Giới hạn phát hiện và giới hạn định lượng (xác định theo quy tắc 3σ [8]) của phương pháp để xác định HgII lần lượt là 0,03 g/L và 0,10 g/L, với thời gian điện phân làm giàu là 270 s. Khoảng tuyến tính của quan hệ Ip−CHg là 0,1 đến 6 g/L. Với giới hạn phát hiện và giới hạn định lượng khá thấp, trên cơ sở các khảo sát đã trình bày ở trên, có thể phát triển được một phương pháp DP-ASV để định lượng lượng vết HgII phục vụ việc quan trắc thủy ngân trong các mẫu nước tự nhiên. 69 Tín hiệu von-ampe hòa tan anot xung vi phân của thủy ngân trên điện cực than thủy tinh 5 5 y = 0.5683x + 0.5860 4 4 R² = 0.9967 3 3 (µA) (µA) p p I I 2 2 1 1 0 0 0 1 2 3 4 5 6 7 8 9 0 1 2 3 4 5 6 7 C (μg/L) C (μg/L) Hg Hg Hình 4. Biến thiên của cường độ dòng đỉnh Ip Hình 5. Đường hồi quy tuyến tính Ip-CHg trong theo nồng độ của Hg. khoảng nồng độ 1−6 g/L. ĐKTN: Edep = -0,9 V; tdep = 270 s; Eclean = 0,9 V; tclean = 30 s; Estart = -0,9 V; Eend = 0,9 V; CAuIII = 0,5 mg/L; CHgII = 5 g/L; CHClO4 = 0,001 M. 4. KẾT LUẬN Trong dung dịch phân tích chứa AuIII 0,5 mg/L, HClO4 0,001 M, cường độ dòng đỉnh hòa tan von-ampe hòa tan anot xung vi phân của HgII ghi được lớn và lặp lại tốt. Với thời gian điện phân làm giàu là 270 s, giới hạn phát hiện của phép đo đối với HgII là 0,03 g/L, giới hạn định lượng là 0,1 g/L, độ lệch chuẩn tương đối của 10 lần đo Ip lặp lại là 6,0%. Khoảng tuyến tính của phương pháp là 0,1 đến 6,0 g/L. Các điều kiện phân tích thích hợp đã chọn là cơ sở để phát triển một phương pháp định lượng lượng vết HgII trong nước tự nhiên. TÀI LIỆU THAM KHẢO [1]. J. Sánchez, E. Castillo, P. Corredor, and J. Ágreda (2011). Determination of mercury by anodic stripping voltammetry in aqua regia extracts, Port. Electrochimica Acta, Vol. 29, No. 3, pp. 197−210. [2]. L.N. Suvarapu, and S.O. Baek (2015). Recent developments in the speciation and determination of mercury using various analytical techniques, J Anal Methods Chem [Online], Vol. 2015, Article ID 372459. Website: https://www.hindawi.com/journals/jamc/2015/372459/. [3]. A. Manivannan, L. Ramakrishnan, M.S. Seehra, E. Granite, J.E. Butler, D.A. Tryk, and A. Fujishima (2005). Mecury detection at boron doped diomond electrodes using a rotating disk technique, J. Electronal.Chem, Vol. 557, pp. 287-293. 70 TẠP CHÍ KHOA HỌC VÀ CÔNG NGHỆ, Trường Đại học Khoa học, ĐH Huế Tập 17, Số 2 (2020) [4]. J. W. Moore, and S. Ramamoorthy (1984). “Mercury”, Heavy metals in natural waters – Applied monitoring and impact assessment, 1st ed., Springer-Verlag New York Inc., USA, pp. 125−134. [5]. F. Okcu, F. N. Ertas, H. I. Gokcel, and H. Tural (2005). Anodic stripping voltammetric behavior of mercury in chloride medium and its determination at a gold film electrode, Turk J Chem Vol. 29, pp. 355 - 366. [6]. A.M. Ashrafi, Z. Koudelkova, E. Sedlackova, L. Richtera, and V.V. Adam (2018). Review−Electrochemical sensors and biosensors for determination of mercury ions, J. Electrochem, Vol. 165, No. 10, pp. B824-B834. [7]. M. Thompson, and P.J. Lowthian (1995). A Horwitz-like function describes precision in a proficiency test, Analyst, Vol. 120, pp. 271−272. [8]. J.N. Miller, and J.C. Miller (2010). “Calibration methods in instrumental analysis: regression and correlation”, Statistics and Chemometrics for Analytical Chemistry, 6th ed., Pearson Education Limited, UK, pp. 124−127. DIFFERENTIAL PULSE - ANODIC STRIPPING VOLTAMMETRY SIGNALS OF MERCURY AT THE GOLD COATED GLASSY CARBON ELECTRODE Nguyen Thi Nhi Phuong1,2, Nguyen Van Hop2, Hoang Thai Long2* 1 Department of Chemistry – Biology – Environmental Science, Pham Van Dong University, Quang Ngai 2 Faculty of Chemistry, University of Sciences, Hue University * Email: hthailong@hueuni.edu.vn ABSTRACT Factors affecting the differential pulse anodic stripping voltammetry peak current of mercury have been investigated on the glassy carbon electrode modified with an in situ formed gold film. In the analyte solution containing AuIII 0.5 mg/L and HClO4 0.001 M, high stripping peak currents of HgII were obtained with good repeatability. With a deposition time of 270 s, the detection limit for HgII was of 0.03 g/L, the relative standard deviation of the 10 repeated Ip measurements was 6.0%. The linear detection range was from 0.1 to 6.0 g/L. Keywords: Anodic stripping voltammetry, gold film, glassy carbon, Hg, mercury. 71 Tín hiệu von-ampe hòa tan anot xung vi phân của thủy ngân trên điện cực than thủy tinh Nguyễn Thị Nhi Phương sinh năm 1979 tại Quảng Ngãi. Bà tốt nghiệp cử nhân Hóa học vào năm 2001, tốt nghiệp thạc sĩ chuyên ngành Hóa phân tích vào năm 2005. Hiện bà là giảng viên của trường Đại học Phạm Văn Đồng, tỉnh Quảng Ngãi và là nghiên cứu sinh chuyên ngành Hóa phân tích tại trường Đại học Khoa học, ĐH Huế. Lĩnh vực nghiên cứu: Phân tích vô cơ, phân tích môi trường. Nguyễn Văn Hợp sinh năm 1956 tại Hà Tĩnh. Ông tốt nghiệp Cử nhân Hoá học năm 1977 tại Trường Đại học Tổng hợp Hà Nội. Ông nhận học vị Tiến sỹ năm 2001 tại Trường Đại học Khoa học Tự nhiên, Đại học Quốc gia Hà Nội và được phong học hàm Phó giáo sư năm 2005. Hiện ông là Giảng viên cao cấp tại Trường Đại học Khoa học, Đại học Huế. Lĩnh vực nghiên cứu: Phát triển phương pháp von-ampe hòa tan phân tích vết các kim loại độc; Quan trắc và đánh giá chất lượng nước, Đánh giá các nguồn ô nhiễm nước, không khí và đất. Hoàng Thái Long sinh năm 1960. Ông tốt nghiệp tiến sĩ Hóa học năm 2011 tại Trường Đại học Khoa học Tự nhiên, Đại học Quốc gia Hà Nội, được phong học hàm Phó giáo sư năm 2018. Hiện nay ông là giảng viên cao cấp của Khoa Hóa học, Trường Đại học Khoa học, Đại học Huế. Lĩnh vực nghiên cứu: Hóa phân tích, Hóa học và Kỹ thuật Môi trường. 72
File đính kèm:
 tin_hieu_von_ampe_hoa_tan_anot_xung_vi_phan_cua_thuy_ngan_tr.pdf
tin_hieu_von_ampe_hoa_tan_anot_xung_vi_phan_cua_thuy_ngan_tr.pdf

