Nghiên cứu sản xuất khí Hêli từ khí thiên nhiên
Trong những thập niên gần đây, kỹ thuật lạnh cryo đã
được chú trọng nghiên cứu và phát triển ở các nước tiên
tiến thuộc châu Âu hay Mỹ. Các khí hóa lỏng được dùng
làm môi chất lạnh cryo để tạo nhiệt độ rất thấp như: nitơ,
oxy, hydro, argon, nêon và hêli, không chỉ thử nghiệm
trong phòng thí nghiệm mà đã đi vào sản xuất công nghiệp,
phục vụ nhiều lĩnh vực nghiên cứu khoa học và nhiều
ngành công nghiệp quan trọng như kỹ thuật siêu dẫn, vật
lý nguyên tử, khoa học vũ trụ, sinh học, y học.
Trong bầu khí quyển của Trái Đất, nồng độ của hêli theo
thể tích chỉ có 5,2 phần triệu. Hầu hết hêli trên Trái Đất là
kết quả của sự phân rã phóng xạ. Do có nhiều tính chất độc
đáo bao gồm điểm sôi rất thấp, mật độ thấp, độ hòa tan thấp,
không gây cháy, có độ dẫn nhiệt cao, trọng lượng phân tử
nhẹ, kích thước phân tử nhỏ, không độc hại và tính trơ, hêli
được sử dụng rất rộng rãi trong nhiều lĩnh vực kỹ thuật như:
lạnh cryo, hàn, luyện kim; lĩnh vực y tế như: máy chụp cộng
hưởng từ MRI; lĩnh vực vật lý siêu dẫn; lĩnh vực vũ trụ
Hêli được ứng dụng nhiều trong kỹ thuật và đời sống, tuy
nhiên nó lại được xem là khí hiếm, vì việc sản suất khí hêli
còn rất khó khăn. Ngoài ra, các mỏ khí thiên nhiên có chứa
nồng độ khí hêli cao đang dần cạn kiệt. Vì vậy, việc sản suất
khí hêli từ khí thiên nhiên có nồng độ hêli thấp hơn là điều tất
yếu. Nhưng nếu hệ thống chỉ sản xuất riêng khí hêli thì hiệu
quả đem lại rất thấp, chính vì vậy, việc sản xuất khí hêli kết
hợp với sản xuất nitơ sẽ là giải pháp tối ưu. Do đó, hệ thống
lạnh cryo tách khí hê li từ khí thiên nhiên đồng thời kết hợp
sản xuất nitơ lỏng được nghiên cứu và phát triển [1, 2, 3].

Trang 1
Trang 2

Trang 3

Trang 4

Trang 5
Tóm tắt nội dung tài liệu: Nghiên cứu sản xuất khí Hêli từ khí thiên nhiên

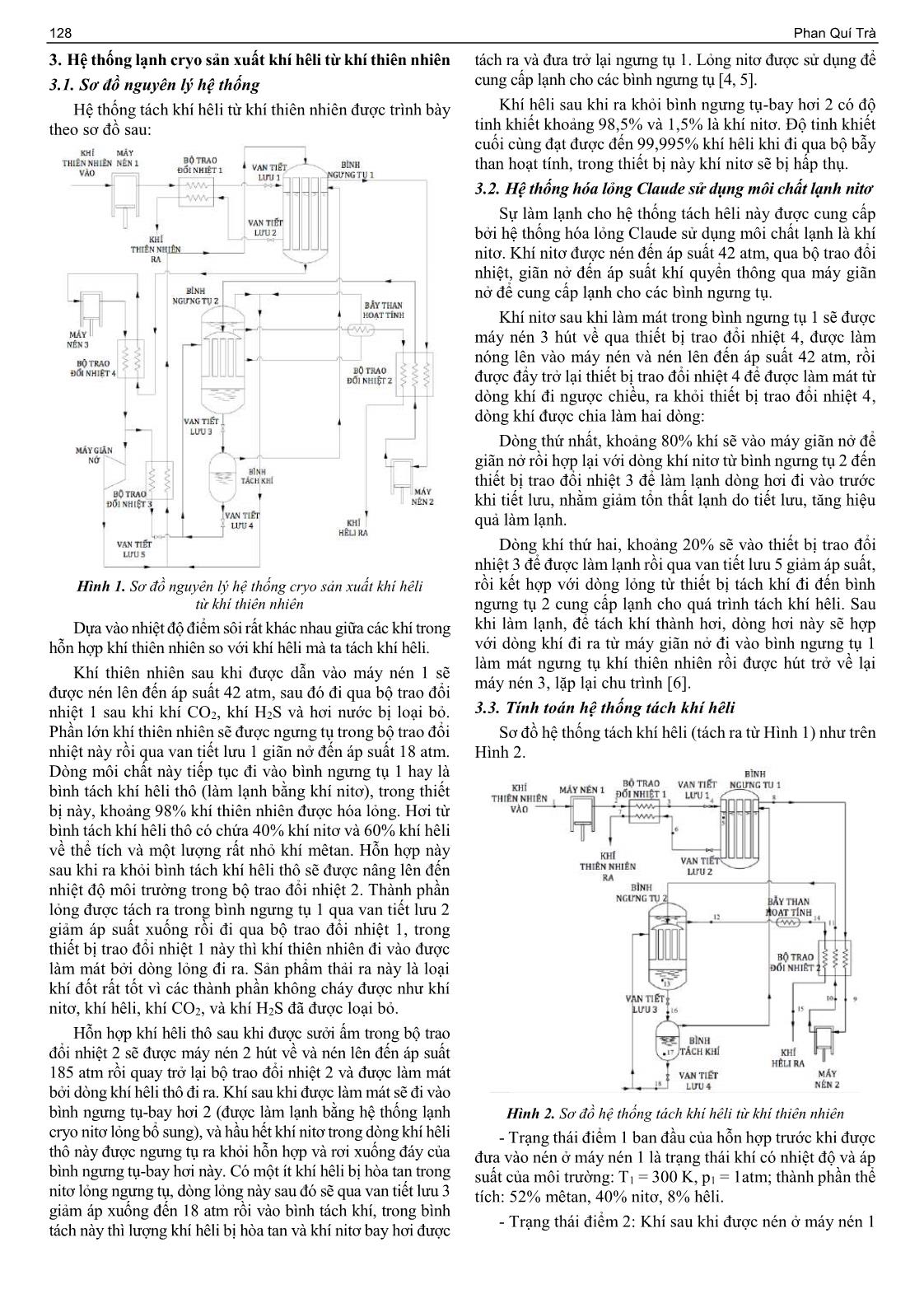
ISSN 1859-1531 - TẠP CHÍ KHOA HỌC VÀ CÔNG NGHỆ ĐẠI HỌC ĐÀ NẴNG, SỐ 11(120).2017, QUYỂN 2 127 NGHIÊN CỨU SẢN XUẤT KHÍ HÊLI TỪ KHÍ THIÊN NHIÊN RESEARCH ON HELIUM EXTRACTION FROM NATURAL GASES Phan Quí Trà Trường Cao đẳng Công nghệ - Đại học Đà Nẵng; pqtra@dct.udn.vn Tóm tắt - Bài báo này giới thiệu tóm tắt các phương pháp tách khí Abstract - This paper shows a brief of methods of helium hêli hiện đang được áp dụng trên thế giới, phân tích ưu, nhược extraction being applied in the world, analyzes the advantages and điểm của các phương pháp này, đồng thời giới thiệu, tính toán, disadvantages of these methods as well as introduces, calculates thiết kế một hệ thống lạnh cryo để tách khí hêli từ khí thiên nhiên. and designs a cryogenic refrigeration system to extract helium from Các kết quả tính toán cho thấy chu trình hệ thống lạnh cryo này có natural gases. Computational results show that the cryogenic hệ số làm lạnh (COP) cao (lên đến 39%) đối với việc tách khí hêli, refrigeration cycle has a high coefficient of performance (COP) (up đồng thời chu trình còn được kết hợp để thu nitơ lỏng. Trong chu to 39%) for the separation of helium, and the cycle is also combined trình lạnh cryo này có sử dụng máy giãn nở, vì vậy, có thể tận dụng to collect liquid nitrogen. In this cryogenic refrigeration cycle, công sinh giãn nở ra để cấp cho máy nén, góp phần tiết kiệm năng expansion machines are used, so it is possible to use the work lượng, tăng COP của toàn chu trình hệ thống và bảo vệ môi produced from expansion to power the compressor, thus trường. contributing to saving energy, increasing the COP of the whole cycle and protecting the environment. Từ khóa - hêli; hệ thống lạnh cryo; khí thiên nhiên; khí hêli; kỹ thuật Key words - helium; cryogenic refrigeration system; natural gases; cryo; tách khí hê li. helium gas; cryo technique; helium extraction. 1. Đặt vấn đề suất. Hêli sẽ được chiết tách ra khỏi dòng khí có độ gia Trong những thập niên gần đây, kỹ thuật lạnh cryo đã nhiệt thấp (low BTU gas), sau đó khí hêli thô này sẽ được được chú trọng nghiên cứu và phát triển ở các nước tiên đưa qua thiết bị tinh chế để đạt độ tinh khiết (lên đến 99%). tiến thuộc châu Âu hay Mỹ. Các khí hóa lỏng được dùng Quá trình thu hồi hêli và tách loại nitơ theo các bước làm môi chất lạnh cryo để tạo nhiệt độ rất thấp như: nitơ, như sau: oxy, hydro, argon, nêon và hêli, không chỉ thử nghiệm (A) Làm mát, tiết lưu và hóa lỏng một phần lượng khí trong phòng thí nghiệm mà đã đi vào sản xuất công nghiệp, thiên nhiên cấp vào thành phần bao gồm mêtan, nitơ và hêli; phục vụ nhiều lĩnh vực nghiên cứu khoa học và nhiều (B) Đưa đưa hỗn hợp lỏng và khí thiên nhiên vào tháp ngành công nghiệp quan trọng như kỹ thuật siêu dẫn, vật chưng cất hoạt động ở áp suất dao động trong khoảng từ lý nguyên tử, khoa học vũ trụ, sinh học, y học. 250 đến 450 PSI; Trong bầu khí quyển của Trái Đất, nồng độ của hêli theo (C) Trong tháp chưng cất, tách mêtan lỏng và hỗn hợp thể tích chỉ có 5,2 phần triệu. Hầu hết hêli trên Trái Đất là nitơ-hêli hơi ra khỏi nhau; kết quả của sự phân rã phóng xạ. Do có nhiều tính chất độc đáo bao gồm điểm sôi rất thấp, mật độ thấp, độ hòa tan thấp, (D) Thu hồi nitơ-hêli hơi từ tháp chưng cất; không gây cháy, có độ dẫn nhiệt cao, trọng lượng phân tử (E) Ngưng tụ từng phần hỗn hợp hơi hêli-nitơ để sản nhẹ, kích thước phân tử nhỏ, không độc hại và tính trơ, hêli xuất khí hêli thô và nitơ lỏng; được sử dụng rất rộng rãi trong nhiều lĩnh vực kỹ thuật như: (F) Gia nhiệt khí hêli thô bằng cách trao đổi nhiệt gián lạnh cryo, hàn, luyện kim; lĩnh vực y tế như: máy chụp cộng tiếp với khí làm mát; hưởng từ MRI; lĩnh vực vật lý siêu dẫn; lĩnh vực vũ trụ (G) Thanh lọc khí hêli thô để sản xuất sản phẩm khí hêli Hêli được ứng dụng nhiều trong kỹ thuật và đời sống, tuy tinh khiết và khí thải có chứa hêli. nhiên nó lại được xem là khí hiếm, vì việc sản suất khí hêli còn rất khó khăn. Ngoài ra, các mỏ khí thiên nhiên có chứa 2.2. Phương pháp khuếch tán hêli qua ống thuỷ tinh Pirex nồng độ khí hêli cao đang dần cạn kiệt. Vì vậy, việc sản suất Phương pháp này ứng dụng đặc tính của thủy tinh Pyrex khí hêli từ khí thiên nhiên có nồng độ hêli thấp hơn là điều tất là gần như không thấm đối với tất cả các loại khí, trừ khí yếu. Nhưng nếu hệ thống chỉ sản xuất riêng khí hêli thì hiệu hêli. Hêli khuếch tán thông qua Pyrex lớn hơn khoảng 25 quả đem lại rất thấp, chính vì vậy, việc sản xuất khí hêli kết lần so với độ khuếch tán của H2 thông qua Pyrex. Người ta hợp với sản xuất nitơ sẽ là giải pháp tối ưu. Do đó, hệ thống cho khí thiên nhiên qua ống thuỷ tinh Pyrex để tách khí lạnh cryo tách khí hê li từ khí thiên nhiên đồng thời kết hợp hêli. Tuy nhiên, phương pháp này hiện chưa thể áp dụng sản xuất nitơ lỏng được nghiên cứu và phát triển [1, 2, 3]. trong công nghiệp do hạn chế về sản lượng hêli thu được. 2.3. Phương pháp tách khí hêli từ khí thiê ... , khoảng 20% sẽ vào thiết bị trao đổi nhiệt 3 để được làm lạnh rồi qua van tiết lưu 5 giảm áp suất, Hình 1. Sơ đồ nguyên lý hệ thống cryo sản xuất khí hêli rồi kết hợp với dòng lỏng từ thiết bị tách khí đi đến bình từ khí thiên nhiên ngưng tụ 2 cung cấp lạnh cho quá trình tách khí hêli. Sau Dựa vào nhiệt độ điểm sôi rất khác nhau giữa các khí trong khi làm lạnh, để tách khí thành hơi, dòng hơi này sẽ hợp hỗn hợp khí thiên nhiên so với khí hêli mà ta tách khí hêli. với dòng khí đi ra từ máy giãn nở đi vào bình ngưng tụ 1 làm mát ngưng tụ khí thiên nhiên rồi được hút trở về lại Khí thiên nhiên sau khi được dẫn vào máy nén 1 sẽ máy nén 3, lặp lại chu trình [6]. được nén lên đến áp suất 42 atm, sau đó đi qua bộ trao đổi nhiệt 1 sau khi khí CO2, khí H2S và hơi nước bị loại bỏ. 3.3. Tính toán hệ thống tách khí hêli Phần lớn khí thiên nhiên sẽ được ngưng tụ trong bộ trao đổi Sơ đồ hệ thống tách khí hêli (tách ra từ Hình 1) như trên nhiệt này rồi qua van tiết lưu 1 giãn nở đến áp suất 18 atm. Hình 2. Dòng môi chất này tiếp tục đi vào bình ngưng tụ 1 hay là bình tách khí hêli thô (làm lạnh bằng khí nitơ), trong thiết bị này, khoảng 98% khí thiên nhiên được hóa lỏng. Hơi từ bình tách khí hêli thô có chứa 40% khí nitơ và 60% khí hêli về thể tích và một lượng rất nhỏ khí mêtan. Hỗn hợp này sau khi ra khỏi bình tách khí hêli thô sẽ được nâng lên đến nhiệt độ môi trường trong bộ trao đổi nhiệt 2. Thành phần lỏng được tách ra trong bình ngưng tụ 1 qua van tiết lưu 2 giảm áp suất xuống rồi đi qua bộ trao đổi nhiệt 1, trong thiết bị trao đổi nhiệt 1 này thì khí thiên nhiên đi vào được làm mát bởi dòng lỏng đi ra. Sản phẩm thải ra này là loại khí đốt rất tốt vì các thành phần không cháy được như khí nitơ, khí hêli, khí CO2, và khí H2S đã được loại bỏ. Hỗn hợp khí hêli thô sau khi được sưởi ấm trong bộ trao đổi nhiệt 2 sẽ được máy nén 2 hút về và nén lên đến áp suất 185 atm rồi quay trở lại bộ trao đổi nhiệt 2 và được làm mát bởi dòng khí hêli thô đi ra. Khí sau khi được làm mát sẽ đi vào bình ngưng tụ-bay hơi 2 (được làm lạnh bằng hệ thống lạnh Hình 2. Sơ đồ hệ thống tách khí hêli từ khí thiên nhiên cryo nitơ lỏng bổ sung), và hầu hết khí nitơ trong dòng khí hêli - Trạng thái điểm 1 ban đầu của hỗn hợp trước khi được thô này được ngưng tụ ra khỏi hỗn hợp và rơi xuống đáy của đưa vào nén ở máy nén 1 là trạng thái khí có nhiệt độ và áp bình ngưng tụ-bay hơi này. Có một ít khí hêli bị hòa tan trong suất của môi trường: T1 = 300 K, p1 = 1atm; thành phần thể nitơ lỏng ngưng tụ, dòng lỏng này sau đó sẽ qua van tiết lưu 3 tích: 52% mêtan, 40% nitơ, 8% hêli. giảm áp xuống đến 18 atm rồi vào bình tách khí, trong bình - Trạng thái điểm 2: Khí sau khi được nén ở máy nén 1 tách này thì lượng khí hêli bị hòa tan và khí nitơ bay hơi được ISSN 1859-1531 - TẠP CHÍ KHOA HỌC VÀ CÔNG NGHỆ ĐẠI HỌC ĐÀ NẴNG, SỐ 11(120).2017, QUYỂN 2 129 đến áp suất p2 = 42 atm, nhiệt độ tăng lên T2, thành phần sự thay đổi nhiệt độ của mỗi chất sau quá trình tiết lưu là thể tích như trạng thái 1. khác nhau nên tương tự như trạng thái điểm 4 ta sẽ tính nhiệt −1 độ của hỗn hợp sau quá trình tiết lưu từ 18 atm xuống 1 atm: 2 2 = 1 ( ) = 710 퐾 (1) [8] + Lỏng mêtan sau quá trình tiết lưu từ áp suất 18 atm 1 xuống 1 atm, nhiệt độ sẽ giảm từ 114 K xuống đến 110 K. Ta sử dụng máy nén nhiều cấp có làm mát trung gian nên nhiệt độ hỗn hợp khí đầu ra giảm xuống T2’ = 320 K. + Lỏng nitơ sau quá trình tiết lưu từ áp suất 18 atm xuống 1 atm, nhiệt độ sẽ giảm từ 114 K xuống đến 77 K. - Trạng thái điểm 3: Là trạng thái sau khi ra khỏi bộ trao đổi nhiệt 1. Sau khi ra khỏi bộ trao đổi nhiệt này, hầu hết khí - Trạng thái điểm 7: Là trạng thái của hỗn hợp lỏng 40% mêtan được ngưng tụ nên nhiệt độ tại trạng thái này của hỗn nitơ và 60% mêtan ra khỏi bộ trao đổi nhiệt 1, áp suất hợp có thể lấy nhỏ hơn so với nhiệt độ ngưng tụ của mêtan p7 = 1 atm. ứng với áp suất p3 = p2 = 42 atm, vậy có thể lấy T3 = 184 K. - Trạng thái điểm 8: Là trạng thái ra khỏi thiết bị ngưng - Trạng thái điểm 4: Là trạng thái sau khi tiết lưu qua tụ 1 đi vào bộ trao đổi nhiệt 2. Là trạng thái hỗn hợp của van tiết lưu 1. Áp suất sau khi tiết lưu của hỗn hợp là 40% khí nitơ và 60% khí hêli về thể tích; nhiệt độ của hỗn 18 atm. Đây là hỗn hợp của 3 chất khác nhau nên sự thay hợp T8 = 120 K; áp suất p8 = 18 atm. đổi nhiệt độ của mỗi chất sau quá trình tiết lưu là khác nhau, - Trạng thái điểm 9: Là trạng thái sau khi ra khỏi bộ trao nên ta sẽ tính nhiệt độ của hỗn hợp sau quá trình tiết lưu từ đổi nhiệt 2. Đây là quá trình trao đổi nhiệt đẳng áp nên 42 atm xuống 18 atm: thành phần và áp suất của hỗn hợp vẫn không đổi p9 = 18 + Lỏng mêtan sau quá trình tiết lưu từ áp suất 42 atm atm. Nhiệt độ của hỗn hợp sau khi qua bộ trao đổi nhiệt xuống 18 atm, nhiệt độ sẽ giảm từ 184 K xuống đến 162 K. tăng lên đến nhiệt độ môi trường T9 = 300 K. + Khí nitơ sau quá trình tiết lưu từ áp suất 42 atm xuống - Trạng thái điểm 10: Là trạng thái sau khi được nén 18 atm, nhiệt độ sẽ giảm từ 184 K xuống đến 174 K. trong máy nén 2. Áp suất của hỗn hợp sau quá trình nén p10 = 185 atm; thành phần của hỗn hợp không đổi. + Khí hêli sau quá trình tiết lưu từ áp suất 42 atm xuống −1 18 atm, nhiệt độ lại tăng từ 184 K lên 187 K. 10 10 = 9 ( ) = 584퐾 [8] Thành phần khối lượng của mỗi chất có trong hỗn hợp 9 được tính theo công thức: Trong đó: k = 1,4 hỗn hợp khí có 3 nguyên tử trở lên. 휇 = 푖 푖 [2] - Trạng thái điểm 11: Là trạng thái sau khi được nén 푖 ∑푛 푖=1 휇푖 푖 trong máy nén 2 sẽ qua trao đổi trong bộ trao đổi nhiệt 2 rồi Trong đó: ra ngoài. Áp suất của hỗn hợp vẫn là p11 = 185 atm; nhiệt độ giảm xuống T11 = 110 K; thành phần của hỗn hợp không đổi. gi là thành phần khối lượng của một chất khí thành phần; - Trạng thái điểm 12: Là trạng thái khí hêli được tách ri là thành phần thể tích của một chất khí thành phần; ra từ thiết bị ngưng tụ 1 đi đến bẩy than hoạt tính. Hêli tách μi là lượng chất tính bằng kg của một chất khí thành ra có độ tinh khiết 98,5%, còn 1,5% là khí nitơ; nhiệt độ phần, trị số bằng phân tử lượng (kmol). T12 = 90 K; áp suất 185 atm. Nhiệt độ của hỗn hợp được tính theo công thức: - Trạng thái điểm 13: Là trạng thái nitơ lỏng được ∑푛 = 푖=1 푖 푖 푖 [2] ngưng tụ hầu hết từ hỗn hợp hêli thô, với áp suất rất cao ∑푛 푖=1 푖 푖 p13 = 185 atm và được ngưng tụ bởi nitơ lỏng có nhiệt độ Trong đó: 77 K nên nitơ trong hỗn hợp trên chuyển trực tiếp từ trạng thái khí sang trạng thái lỏng mà không qua trạng thái hơi cpi là nhiệt dung riêng đẳng áp của một chất khí thành phần (tra bảng); bão hòa, nhằm tăng hiệu quả tách khí nitơ ra khỏi khí hêli. Nhiệt độ T13 = 90 K; thành phần lỏng nitơ này có một lượng Ti là nhiệt độ của một chất khí thành phần. rất nhỏ khí hêli bị hấp thụ vào, khoảng 5% tổng lượng hêli Thay các đại lượng vào ta được bảng tính toán sau: vào bình ngưng tụ 2. - Trạng thái điểm 5: Là trạng thái hỗn hợp trong bình Ta sẽ tính thành phần hêli và nitơ trong hỗn hợp ở trạng ngưng tụ 1, có áp suất 18 atm. Trong thiết bị này, khí nitơ thái 13 bằng cách quy về thành phần phần trăm của hỗn sẽ được ngưng tụ nên nhiệt độ của hỗn hợp sẽ có nhiệt độ hợp khi mới đi vào bình ngưng tụ 2, thành phần lúc này là: bằng nhiệt độ ngưng tụ của nitơ ở áp suất 18 atm, vậy T5 = 60% hêli, 40% nitơ, lượng hêli hấp thụ vào lỏng nitơ là 5% 114 K, thành phần thể tích của từng chất lỏng trong hỗn nên sẽ chiếm: 0,05x60% = 3% trong 60% hêli trong hỗn hợp như sau: khí mêtan ngưng tụ gần như hoàn toàn trong hợp ban đầu, còn lại 57% chính là 98,5% ở trạng thái điểm 1,5% 57% thiết bị này nên có thành phần thể tích là 52% trong hỗn 13, khi đó nitơ 1,5% sẽ chiếm: = 0,87%. Nên hợp khí ban đầu, khí nitơ ngưng tụ phần lớn còn một phần 98,5% nhỏ theo hỗn hợp khí hêli thô, có thành phần gồm 40% khí lượng nitơ ngưng tụ ở trạng thái điểm 13 sẽ chiếm: nitơ và 60% khí hêli (chính là toàn bộ 8% thể tích trong 40% - 0,87% = 39,13% so với hỗn hợp ban đầu. hỗn hợp ban đầu) về thể tích đi ra khỏi bình ngưng tụ 1. Vậy thành phần hêli và nitơ trong hỗn hợp ở trạng thái 13 là: 100% - Trạng thái điểm 6: Là trạng thái của hỗn hợp lỏng gồm + Hêli: 3% = 7,12% mêtan và nitơ sau khi tiết lưu qua van tiết lưu 2, áp suất giảm 3%+39,13% 100% từ 18 atm xuống 1 atm, thành phần thể tích của hỗn hợp là + Nitơ: 39,13% = 92,88% 3%+39,13% 60% CH4, 40% N2. Vì đây là hỗn hợp của hai chất khác nhau, 130 Phan Quí Trà - Trạng thái điểm 14: Là trạng thái khí ra khỏi bẩy than Trong đó: k = 1,4 hỗn hợp khí có 3 nguyên tử trở lên. hoạt tính, hêli có độ tinh khiết khoảng 99,995%; nhiệt độ Tương tự, máy nén cũng được làm mát nên nhiệt độ ra T14 = 90 K; áp suất p14 = 185 atm. khỏi máy nén gần như bằng với nhiệt độ đầu vào T2’ = 320 K. - Trạng thái điểm 15: Là trạng thái khí hêli có độ tinh - Trạng thái điểm 3’: Là trạng thái sau khi trao đổi nhiệt khiết 99,995% ra khỏi bộ trao đổi nhiệt 2, áp suất ở trạng trong bộ trao đổi nhiệt 4, nhiệt độ giảm xuống còn thái này p15 = 185 atm. T3’ = 250 K, vì đây là quá trình trao đổi nhiệt đẳng áp nên - Trạng thái điểm 16: Là trạng thái sau khi ra khỏi van p3’ = 42 atm. tiết lưu 3, nhiệt độ T16 = 95 K, áp suất giảm đến p18 = 18 - Trạng thái điểm 4’: Là trạng thái sau khi trao đổi nhiệt atm vào bình tách khí để tách khí hêli bị hấp thụ ra, sau đó trong bộ trao đổi nhiệt 3 để vào van tiết lưu 5, nhiệt độ giảm lượng khí này cùng với một lượng nhỏ hơi nitơ bốc ra được xuống đến T4’ = 130 K, áp suất không đổi p4’ = 42 atm, đưa vào bình ngưng tụ 1 để tiếp tục tách khí hêli. nhưng khối lượng ở trạng thái này chỉ có 20% của khối - Trạng thái điểm 17: Là trạng thái nitơ lỏng trong bình lượng ban đầu. tách khí, áp suất p17 = 18 atm, nhiệt độ T17 = 95 K. - Trạng thái điểm 5’: Là trạng thái sau khi tiết lưu trong - Trạng thái điểm 18: Là trạng thái lỏng nitơ sau van van tiết lưu 5, nhiệt độ giảm xuống đến T5’ = 77 K, áp suất tiết lưu 4, nhiệt độ T18 = 77 K, áp suất p18 = 1 atm. sau quá trình tiết lưu là p5’ = 1 atm. Từ những phân tích và tính toán ở trên ta có bảng kết - Trạng thái điểm 7’: Là trạng thái sau khi làm lạnh hóa quả trạng thái các điểm nút như Bảng 1. lỏng nitơ trong hỗn hợp khí hêli - nitơ, nhiệt độ T7’ = 77 K, Bảng 1. Bảng kết quả trạng thái các áp suất p7’ = 1 atm. điểm nút hệ thống chính tách khí hêli - Trạng thái điểm 8’: Là trạng thái sau khi ra khỏi máy Áp suất Nhiệt độ Thành phần (%) giãn nở, nhiệt độ giảm xuống đến T8’ = 87 K, áp suất sau Điểm (atm) (K) Mêtan Nitơ Hêli khi giãn nở p8’ = 1 atm. 1 1 300 52 40 8 2 42 320 52 40 8 3 42 184 52 40 8 4 18 166 52 40 8 5 18 114 60 40 - 6 1 96 60 40 - 7 1 210 60 40 - 8 18 120 - 40 60 9 18 300 - 40 60 10 185 320 - 40 60 11 185 110 - 40 60 12 185 90 - 1,5 98,5 13 185 90 - 92,88 7,12 14 185 90 - - 99,995 15 185 151 - - 99,995 16 18 85 - 92,88 7,12 17 18 95 - 100 - 18 1 77 - 100 - 3.4. Tính toán hệ thống hoá lỏng Claude sử dụng môi Hình 3. Sơ đồ nguyên lý hệ thống lạnh cryo sử dụng chất nitơ môi chất nitơ Sơ đồ hệ thống lạnh cryo theo chu trình Claude sử dụng Dựa vào các phương trình cân bằng nhiệt tại các thiết môi chất nitơ (tách ra từ Hình 1) như Hình 3. bị trao đổi nhiệt và các điểm hoà trộn, ta có bảng trạng thái Ta có trạng thái của các điểm nút như sau: tại các điểm nút như Bảng 2. - Trạng thái điểm 1’: Là trạng thái điểm vào máy nén 3 Bảng 2. Trạng thái các điểm nút của chu trình lạnh Claude có áp suất p1’ = 1 atm, nhiệt độ bằng nhiệt độ môi trường sử dụng môi chất nitơ T1’ = 300 K. Điểm Nhiệt độ (K) Áp suất (atm) Trạng thái - Trạng thái điểm 2’: Là trạng thái sau khi ra khỏi máy 1’ 300 1 hơi thấp áp nén 3, được nén tăng đến áp suất p2’ = 42 atm, thành phần 2’ 320 42 hơi cao áp thể tích như trạng thái 1’. 3’ 250 42 hơi cao áp −1 = ( 2′) = 873퐾 [8] 4’ 130 42 hơi cao áp 2′ 1′ 1′ 5’ 77 1 hơi hạ áp ISSN 1859-1531 - TẠP CHÍ KHOA HỌC VÀ CÔNG NGHỆ ĐẠI HỌC ĐÀ NẴNG, SỐ 11(120).2017, QUYỂN 2 131 6’ 77 1 lỏng thấp áp Qua tính toán chu trình ta có COP = 39%. Ngoài ra, chu 7’ 77 1 hơi thấp áp trình còn có những ưu điểm sau: 8’ 87 1 hơi thấp áp + Do kết hợp thu nitơ lỏng nên hiệu quả của chu trình được nâng lên đáng kể; 9’ 85 1 hơi thấp áp + Chu trình sử dụng cả van tiết lưu và máy giãn nở, 10’ 109 1 hơi thấp áp trong đó quá trình giãn nỡ làm lạnh khí tốt hơn và công 11’ 228 1 hơi thấp áp sinh ra có thể tham gia truyền động máy nén tiết kiệm năng 12’ 297 1 hơi thấp áp lượng cung cấp từ bên ngoài. Đây cũng là yếu tố nâng cao 3.5. COP của toàn hệ thống sản xuất khí hêli hệ số làm lạnh chu trình. COP của hệ thống được tính theo công thức: Nhược điểm: ∑ 푄푖 + Sử dụng máy giãn nở và nhiều thiết bị hồi nhiệt nên 푃 = hệ thống phức tạp, khó khăn trong điều khiển tự động; ∑ 푙푖 Do chu trình có sử dụng máy giãn nở, công máy giãn + Các thiết bị trong hệ thống phải làm việc trong điều nở sinh ra sử dụng để truyền động máy nén nên công nén kiện áp suất cao; của chu trình được tính như sau: + Vận hành và quản lý hệ thống phức tạp. ∑ 푙푖 = 푙1 + 푙2 + 푙3 − 푙4 TÀI LIỆU THAM KHẢO Nhiệt lượng hữu ích thu được trong toàn chu trình được tính: [1] A.J. Reyzewski, Refrigeranttion, cryogenics, optics and miscellaneous, Engineering department, I.I.du pont de Nemours ∑ 푄푖 = 푄1 + 푄2 + 푄3 + 푄4 Co. Inc., McGraw-Hill, 1996. [2] Arthur J. Kidnay, William R. Parrish, Fundamentals of Natural Gas Tính toán các giá trị công và nhiệt đồng thời thay vào Processing, Taylor and Francis Group, LLC. New York, 2006. các công thức trên ta có COP = 39%. [3] E.W. Lemon, Thermophysical properties of fluids and materials, NIST Chemistry WebBook, 2009. 4. Kết luận [4] Frank G. Kerry, Industrial Gas Handbook Gas Separation and Hiện nay, nhu cầu sử dụng khí hêli trên thế giới ngày Purification, Taylor & Francis Group, LLC. New York, 2006. một tăng do nhiều ứng dụng hữu ích của hêli, vì vậy, việc [5] Isidoro Martinez, Heat exchangers, Academic website 1995-2017 by Isidoro Martinez, pp. 9-12. nghiên cứu một chu trình sản xuất khí hêli có hiệu suất cao [6] J.-M. Reneaume, N. Niclout, “MINLP Optimization of Plate fin Heat là rất cần thiết. Exchangers”, Chem. Biochem. Eng., Q. 17 (1), 2003, pp. 65-76. Trữ lượng mỏ khí thiên nhiên giàu hêli ngày càng [7] Randall Barron, Cryogenic Systems, McGraw-Hill Inc., 1996. giảm. Vì vậy, việc khai thác khí thiên nhiên có nồng độ [8] Phạm Lê Dần, Bùi Hải, Nhiệt động kỹ thuật, NXB Khoa học và Kỹ hêli thấp là điều tất yếu. Do đó chu trình sản xuất khí hêli thuật Hà Nội, 2000, pp. 24-50. từ khí thiên nhiên được trình bày trong bài báo là giải [9] Nguyễn Thị Minh Hiền, Công nghệ chế biến khí tự nhiên và khí đồng pháp cho vấn đề này. hành, Nhà xuất bản Khoa học và Kỹ thuật Hà Nội, 2002. (BBT nhận bài: 05/10/2017, hoàn tất thủ tục phản biện: 24/10/2017)
File đính kèm:
 nghien_cuu_san_xuat_khi_heli_tu_khi_thien_nhien.pdf
nghien_cuu_san_xuat_khi_heli_tu_khi_thien_nhien.pdf

