Chế tạo hạt nano chitosan-TPP tải insulin bằng phương pháp tạo gel ion
Trong đề tài này việc chế tạo hạt nano chitosan tải insulin được thực hiện bằng phương pháp tạo gel ion, sử dụng tác nhân tạo liên kết ngang sodium tripolyphosphate. Để thu được kết quả chế tạo hạt nano tốt
nhất có thể, đề tài thực hiện tái deacetyl hóa chitosan ban đầu (độ deacetyl hóa (DD) khoảng 75 %) và thu được chitosan sau tái deacetyl hóa có DD khoảng 85 – 90 %, DD được xác định bằng phương pháp FTIR. Từ chitosan tái deacetyl hóa này, chúng tôi thực hiện khảo sát tạo hạt ở các điều kiện pH khác nhau (pH = 2; 3,5; 5), tại các nồng độ chitosan khác nhau (0,5; 1; 2; 4 mg/mL) và các tỉ lệ khối lượng giữa chitosan so với tác nhân liên kết ngang khác nhau (2:1; 4:1; 6:1; 8:1), để rút ra một bộ thông số phù hợp nhất về kích thước và phân bố kích thước hạt. Thông qua đó, hạt nano chitosan-TPP tải insulin được chế tạo đạt hiệu suất tải thuốc 91,6 % tại môi trường có pH = 3,5; nồng độ chitosan là 1 mg/mL; tỉ lệ khối lượng giữa
chitosan so với tác nhân liên kết ngang là 4:1. Hình ảnh TEM cho thấy hạt có kích thước nhỏ hơn 100 nm, hình dạng khá tròn, khi đo phổ FTIR có thể chứng minh được sự tồn tại của những liên kết cơ bản giữa
chitosan và tác nhân tạo liên kết ngang trong việc hình thành hạt. Dựa trên kết quả phân tích phổ FTIR và hiệu suất bao gói, chúng tôi xác định đã chế tạo thành công hạt nano chitosan-TPP tải insulin làm nguyên liệu đầu tiên cho những khảo sát sâu hơn nữa, nhằm mang hạt nano chitosan tải insulin vào ứng
dụng thực tiễn.

Trang 1

Trang 2

Trang 3
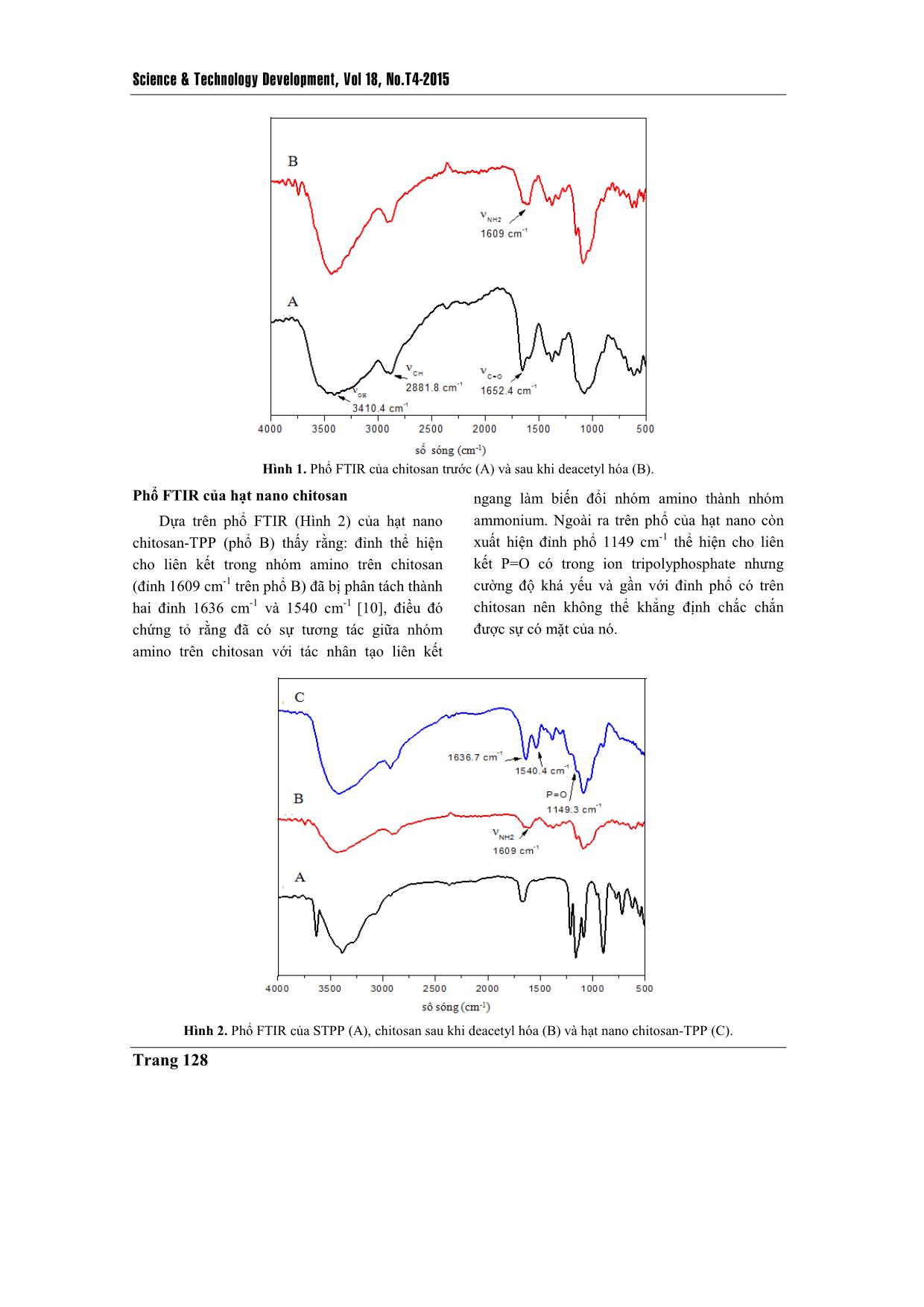
Trang 4
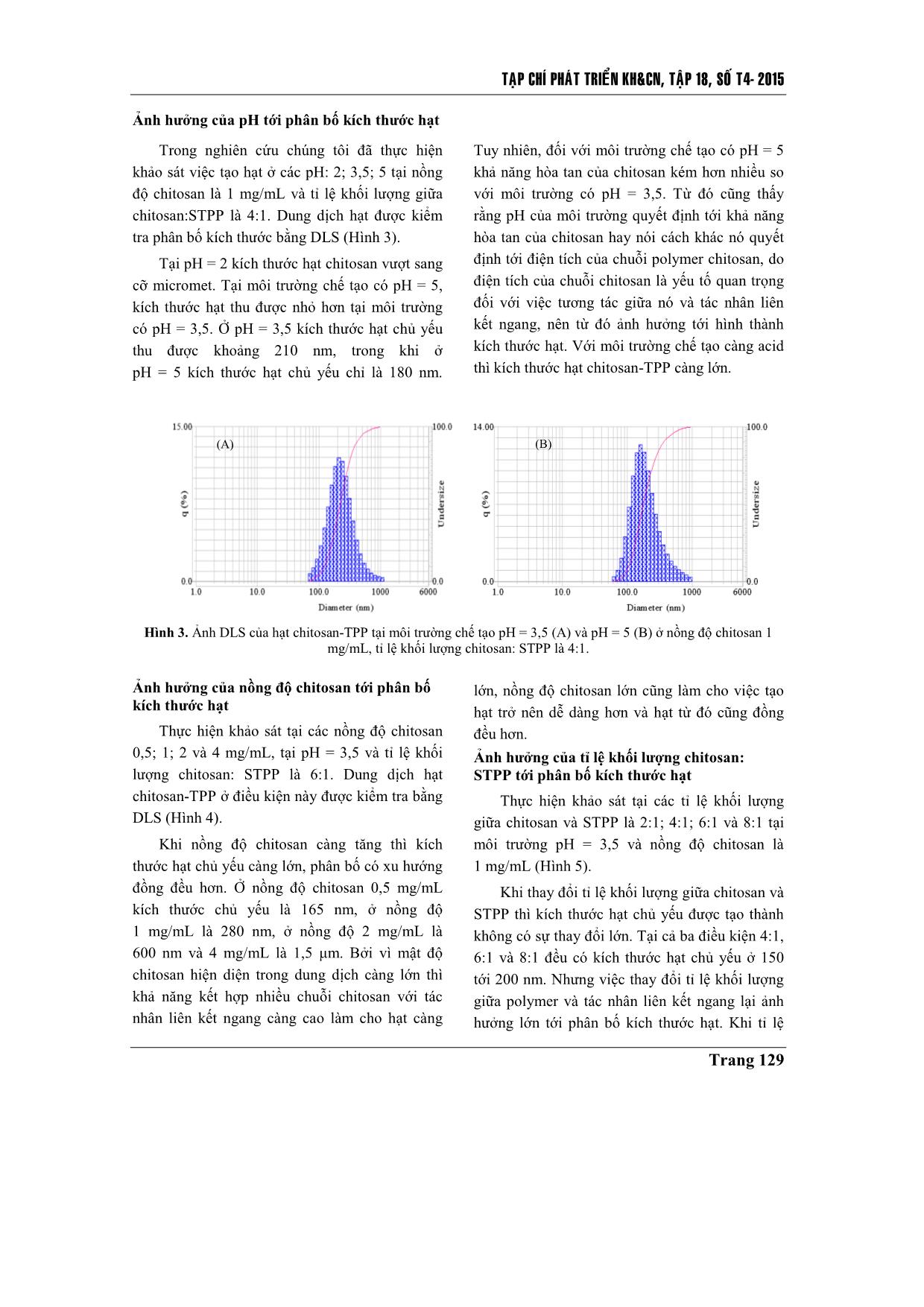
Trang 5
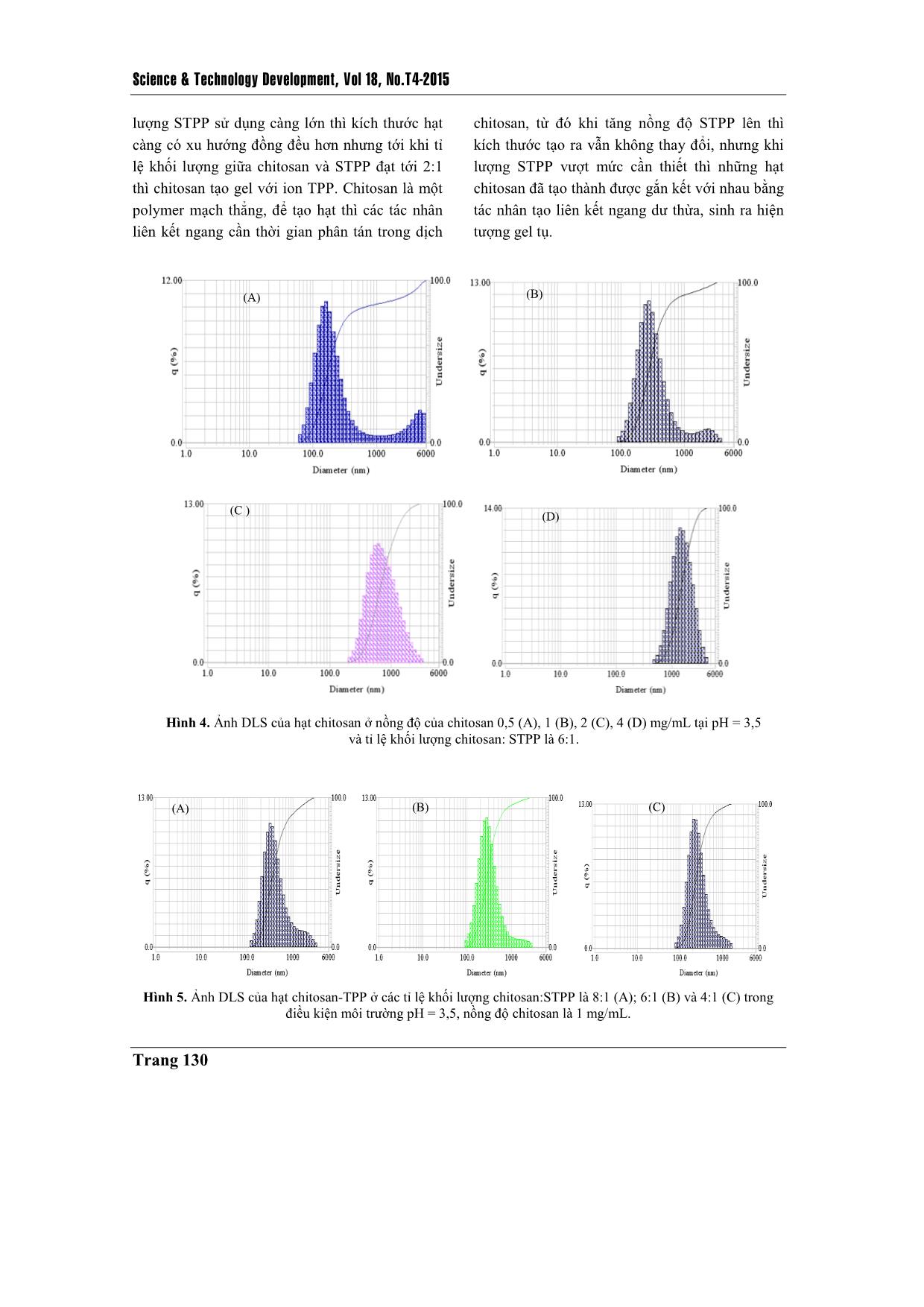
Trang 6
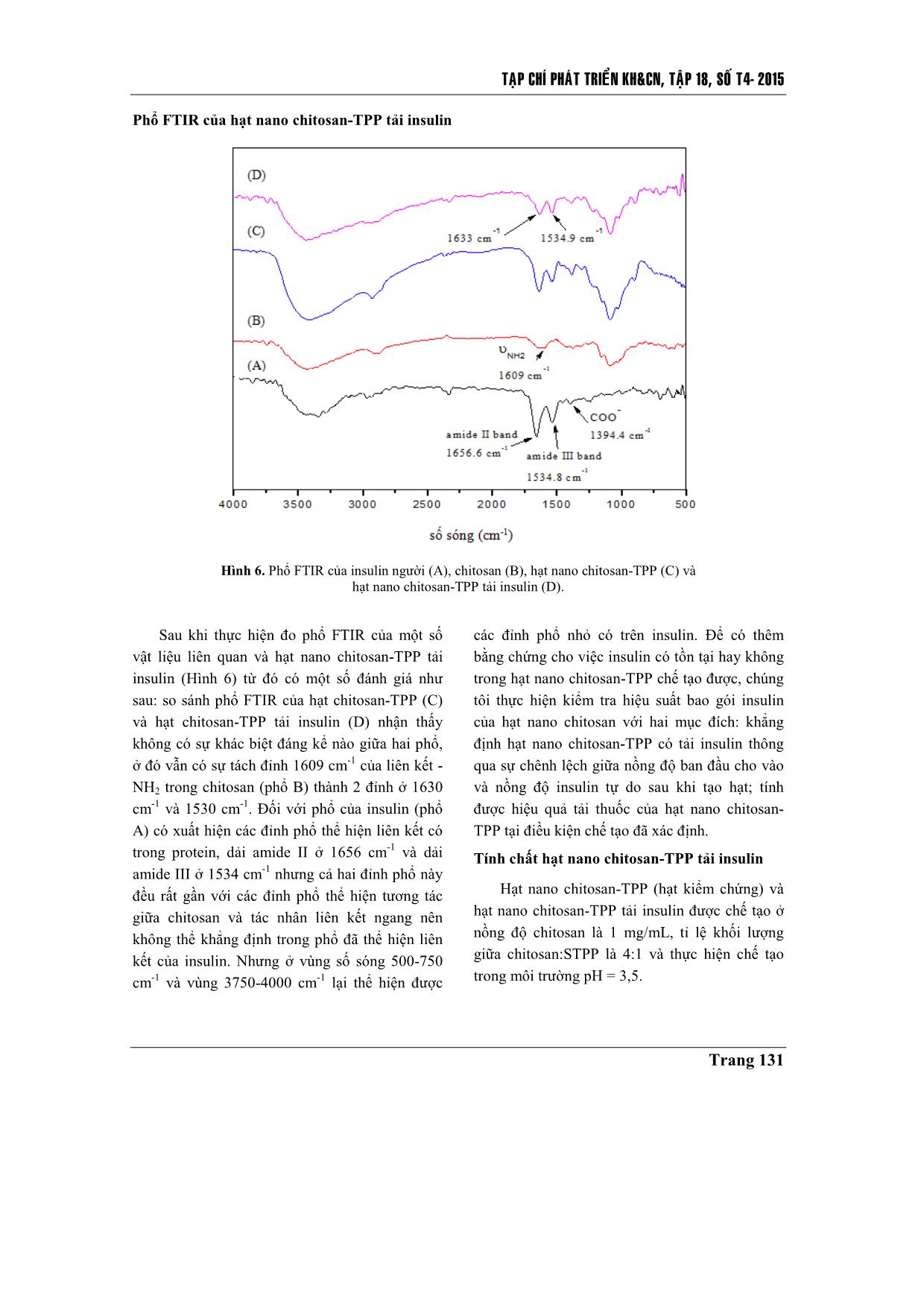
Trang 7
Trang 8

Trang 9

Trang 10
Tóm tắt nội dung tài liệu: Chế tạo hạt nano chitosan-TPP tải insulin bằng phương pháp tạo gel ion

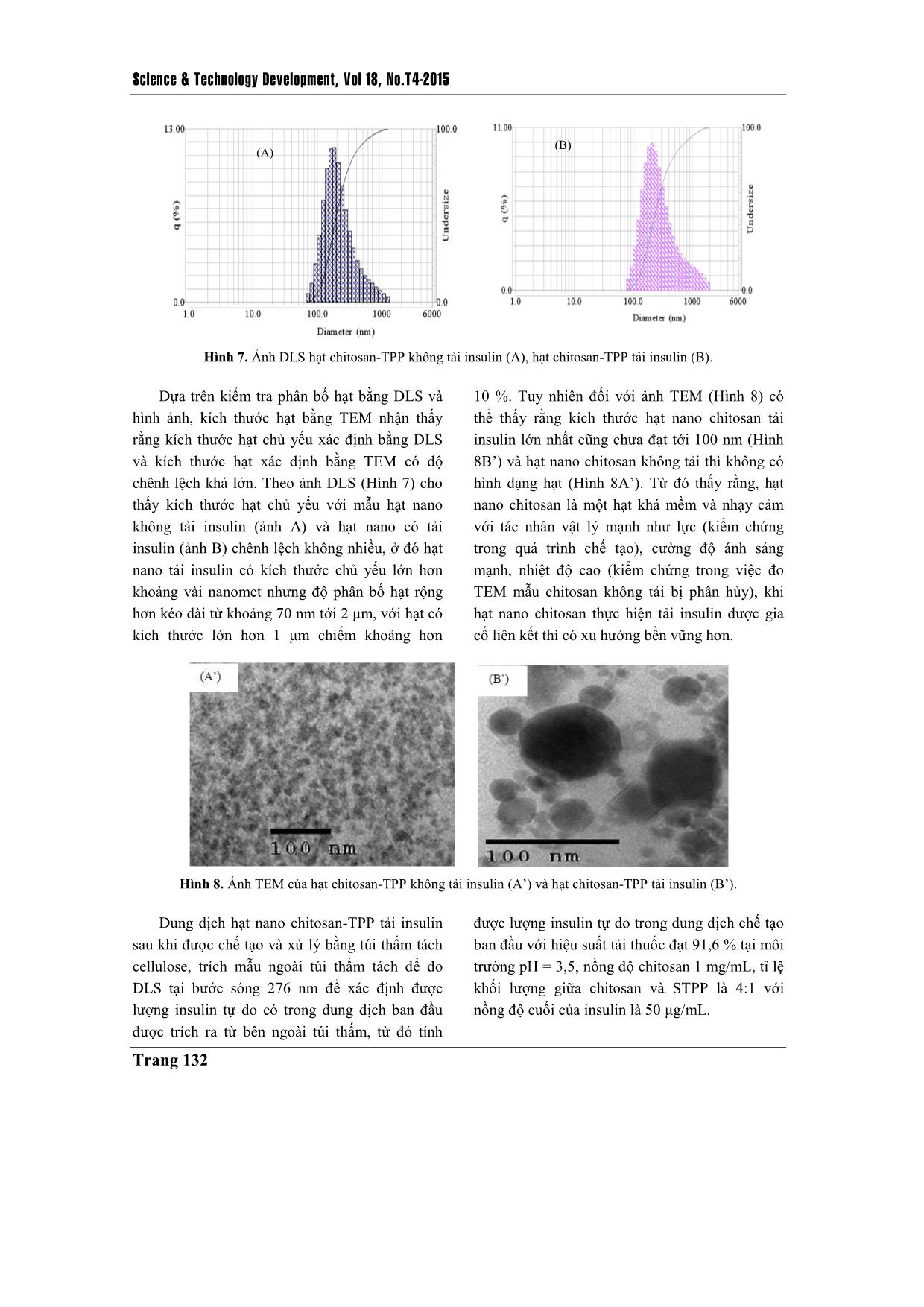
TAÏP CHÍ PHAÙT TRIEÅN KH&CN, TAÄP 18, SOÁ T4- 2015 Trang 125 Chế tạo hạt nano chitosan-TPP tải insulin bằng phương pháp tạo gel ion Đinh Thị Huyền Trang Nguyễn Đức Hảo Lê Văn Hiếu Trường Đại học Khoa học Tự nhiên, ĐHQG-HCM Hồ Thanh Hà PTN Công nghệ Nano (LNT), ĐHQG-HCM ( Bài nhận ngày 10 tháng 12 năm 2014, nhận đăng ngày 23 tháng 09 năm 2015) TÓM TẮT Trong đề tài này việc chế tạo hạt nano chitosan tải insulin được thực hiện bằng phương pháp tạo gel ion, sử dụng tác nhân tạo liên kết ngang sodium tripolyphosphate. Để thu được kết quả chế tạo hạt nano tốt nhất có thể, đề tài thực hiện tái deacetyl hóa chitosan ban đầu (độ deacetyl hóa (DD) khoảng 75 %) và thu được chitosan sau tái deacetyl hóa có DD khoảng 85 – 90 %, DD được xác định bằng phương pháp FTIR. Từ chitosan tái deacetyl hóa này, chúng tôi thực hiện khảo sát tạo hạt ở các điều kiện pH khác nhau (pH = 2; 3,5; 5), tại các nồng độ chitosan khác nhau (0,5; 1; 2; 4 mg/mL) và các tỉ lệ khối lượng giữa chitosan so với tác nhân liên kết ngang khác nhau (2:1; 4:1; 6:1; 8:1), để rút ra một bộ thông số phù hợp nhất về kích thước và phân bố kích thước hạt. Thông qua đó, hạt nano chitosan-TPP tải insulin được chế tạo đạt hiệu suất tải thuốc 91,6 % tại môi trường có pH = 3,5; nồng độ chitosan là 1 mg/mL; tỉ lệ khối lượng giữa chitosan so với tác nhân liên kết ngang là 4:1. Hình ảnh TEM cho thấy hạt có kích thước nhỏ hơn 100 nm, hình dạng khá tròn, khi đo phổ FTIR có thể chứng minh được sự tồn tại của những liên kết cơ bản giữa chitosan và tác nhân tạo liên kết ngang trong việc hình thành hạt. Dựa trên kết quả phân tích phổ FTIR và hiệu suất bao gói, chúng tôi xác định đã chế tạo thành công hạt nano chitosan-TPP tải insulin làm nguyên liệu đầu tiên cho những khảo sát sâu hơn nữa, nhằm mang hạt nano chitosan tải insulin vào ứng dụng thực tiễn. Từ khóa: nano chitosan, tác nhân tạo liên kết ngang sodium tripolyphosphate, tạo gel ion, insulin. MỞ ĐẦU Để nâng cao chất lượng trong điều trị bệnh và phục vụ nhu cầu sống ngày càng cao, người ta luôn tìm cách cải tiến khả năng ứng dụng của các dạng vật liệu sử dụng trong y sinh, và các dạng vật liệu này phải đáp ứng những yêu cầu cơ bản như tính tương thích sinh học cao, có khả năng tự đào thải và không gây độc tính, ngoài ra còn ưu tiên các chỉ tiêu như đơn giản, dễ chế tạo, giá thành thấp, đối với hệ tải thuốc nano cũng như vậy. Trong nhiều năm qua, đây là lĩnh vực thu hút được sự quan tâm lớn và bước đầu đã đạt được kết quả, nhưng cũng chỉ là bắt đầu sơ khai một nền công nghệ mới – công nghệ vật liệu nano ứng dụng trong y sinh. Với đề tài này nhóm thực hiện chế tạo hệ hạt nano chitosan tải insulin nhằm hướng tới một hệ tải có thể sử dụng cho đường uống trong trị bệnh đái tháo đường. Science & Technology Development, Vol 18, No.T4-2015 Trang 126 Chitosan là một loại polysaccharide không phổ biến trong tự nhiên nhưng có thể thu được thông qua deacetyl hóa chitin (có nhiều trong động vật giáp xác và nấm). Chitosan là một polymer mạch thẳng chứa nhiều đơn vị β-(1-4)-2- amino-2-deoxy-D-glucopyranose, cũng là poly- cationic, không độc tính, có khả năng phân hủy và tương thích sinh học cao. Ngoài ra, chitosan có thể tan trong một số acid hữu cơ với pH nhỏ hơn 6.5 như acid formic, acetic, tartaric, citric. Thông thường đối với một chitosan thì tỉ lệ của nhóm amino cần đạt trên 50 % so với nhóm acetyl [1, 2, 3]. Để tạo hệ hạt nano trên vật liệu cơ bản chitosan, đề tài đã thực hiện chế tạo bằng phương pháp tạo gel ion với tác nhân tạo liên kết ngang là sodium tripolyphophate (STPP). So với những chất tạo liên kết ngang hóa học như glutaraldehyde; glyoxal; 2,2-dimethoxy phenyl- acetophenonethì STPP là chất không có độc tính, ngoài ra nó còn là một muối khá dễ tan, kích thước nhỏ. Từ những tính chất đó, STPP được chọn làm tác nhân liên kết ngang trong tạo hạt dạng nano ứng dụng trong y sinh [4]. Insulin là hormon protein rất quan trọng đối với việc điều hòa đường huyết, nó là hormon duy nhất có thể chuyển hóa đường tự do thành dạng glycogen. Khi cơ thể thiếu insulin, chúng sẽ được bổ sung bằng đường tiêm do dễ bị phân hủy bởi môi trường pH thấp cũng như hoạt động của enzym protenase có trong đường tiêu hóa [5, 6]. Tuy nhiên, đường truyền thuốc này lại gây ra khá nhiều phiền toái từ cách bảo quản tới những phản ứng phụ có thể phát sinh. Hạt nano chitosan-TPP được nghiên cứu để trở thành một trong những giải pháp cho vấn đề này. Hệ hạt chitosan có khả năng bảo vệ thuốc ở bên trong hạt tải để tránh tiếp xúc với môi trường bên ngoài, cùng kích thước ở mức nano hạt tải có thể dễ dàng xâm nhập vào đường máu và nhả thuốc trong thời gian dài [3, 7]. VẬT LIỆU VÀ PHƯƠNG PHÁP NGHIÊN CỨU Vật liệu Chitosan dạng bột với độ deacetyl (DD) khoảng 75 % của Himedia Laboratories (Ấn Độ) là sản phẩm được deacetyl hóa từ chiti ... để kiểm tra liên kết bằng phổ FTIR. Kiểm tra hiệu suất bao gói Sử dụng túi thấm tách cellulose (kích thước 1 x 50 ft, có thể thấm lọc chất có kích thước tối đa 12 – 14 kDa) để tính hiệu suất bao gói thuốc thông qua nguyên tắc cân bằng nồng độ trong và ngoài túi thấm tách. Cho dung dịch hạt nano chitosan-TPP tải insulin vào trong túi thấm tách đã được xử lý bằng nước DI và nhúng hệ vào trong nước DI, khuấy từ bên ngoài túi liên tục trong 4 giờ. Trích mẫu bên ngoài túi thấm tách để xác định cường độ hấp thụ ánh sáng ở bước sóng 276 nm bằng máy UV-vis (Ultraviolet-visible Spectroscopy, Cary 100, Australia, được đặt tại Phòng thí nghiệm công nghệ Nano, ĐHQG- HCM). KẾT QUẢ - THẢO LUẬN Kết quả deacetyl hóa qua FTIR Để đánh giá mức thành công của việc tái deacetyl hóa, chúng tôi tiến hành đo phổ FTIR của bột chitosan trước và sau khi tái deacetyl hóa. Dựa trên phổ FTIR thu được (Hình 1) tại vùng số sóng 3500 cm -1 và 2880 cm -1 thể hiện cho các liên kết O-H và C-H có trên cả chitosan trước và sau khi thực hiện tái deacetyl hóa, riêng với đỉnh tại số sóng 1652 cm-1 và 1609 cm-1 thể hiện cho nhóm acetyl và nhóm amino trên chitosan thì khác nhau trên mỗi phổ [9, 10]. Trên phổ của chitosan trước deacetyl hóa liên kết C=O có trong nhóm acetyl thể hiện rất rõ ràng (phổ A), trong khi sau khi tái deacetyl hóa (phổ B) thì liên kết - NH2 lại thể hiện rõ ràng hơn. Điều đó chứng minh rằng, quá trình tái deacetyl hóa đã diễn ra thành công. Để xác định mức độ thành công của quá trình tái deacetyl hóa, nhóm đề tài thực hiện xác định DD của chitosan trước và sau khi tái deacetyl hóa bằng phương pháp phổ FTIR. Dựa vào tỉ lệ giá trị cường độ hấp thụ (truyền qua) của một số đỉnh phổ FTIR (thí dụ vùng liên kết O-H, C-H, C=O, - CH2 và vùng amide III) của chitosan trước và sau khi tái deacetyl hóa cùng một số công thức xác định DA đã được báo cáo [11], từ đó xác định được DD của chitosan trước và sau khi thực hiện tái deacetyl hóa. Với chitosan trước khi tái deacetyl hóa có DD khoảng 75 % và sau khi thực hiện tái deacetyl hóa thì DD của chitosan tăng lên tới 85 % - 90 %. Science & Technology Development, Vol 18, No.T4-2015 Trang 128 Hình 1. Phổ FTIR của chitosan trước (A) và sau khi deacetyl hóa (B). Phổ FTIR của hạt nano chitosan Dựa trên phổ FTIR (Hình 2) của hạt nano chitosan-TPP (phổ B) thấy rằng: đỉnh thể hiện cho liên kết trong nhóm amino trên chitosan (đỉnh 1609 cm-1 trên phổ B) đã bị phân tách thành hai đỉnh 1636 cm-1 và 1540 cm-1 [10], điều đó chứng tỏ rằng đã có sự tương tác giữa nhóm amino trên chitosan với tác nhân tạo liên kết ngang làm biến đổi nhóm amino thành nhóm ammonium. Ngoài ra trên phổ của hạt nano còn xuất hiện đỉnh phổ 1149 cm-1 thể hiện cho liên kết P=O có trong ion tripolyphosphate nhưng cường độ khá yếu và gần với đỉnh phổ có trên chitosan nên không thể khẳng định chắc chắn được sự có mặt của nó. Hình 2. Phổ FTIR của STPP (A), chitosan sau khi deacetyl hóa (B) và hạt nano chitosan-TPP (C). TAÏP CHÍ PHAÙT TRIEÅN KH&CN, TAÄP 18, SOÁ T4- 2015 Trang 129 Ảnh hưởng của pH tới phân bố kích thước hạt Trong nghiên cứu chúng tôi đã thực hiện khảo sát việc tạo hạt ở các pH: 2; 3,5; 5 tại nồng độ chitosan là 1 mg/mL và tỉ lệ khối lượng giữa chitosan:STPP là 4:1. Dung dịch hạt được kiểm tra phân bố kích thước bằng DLS (Hình 3). Tại pH = 2 kích thước hạt chitosan vượt sang cỡ micromet. Tại môi trường chế tạo có pH = 5, kích thước hạt thu được nhỏ hơn tại môi trường có pH = 3,5. Ở pH = 3,5 kích thước hạt chủ yếu thu được khoảng 210 nm, trong khi ở pH = 5 kích thước hạt chủ yếu chỉ là 180 nm. Tuy nhiên, đối với môi trường chế tạo có pH = 5 khả năng hòa tan của chitosan kém hơn nhiều so với môi trường có pH = 3,5. Từ đó cũng thấy rằng pH của môi trường quyết định tới khả năng hòa tan của chitosan hay nói cách khác nó quyết định tới điện tích của chuỗi polymer chitosan, do điện tích của chuỗi chitosan là yếu tố quan trọng đối với việc tương tác giữa nó và tác nhân liên kết ngang, nên từ đó ảnh hưởng tới hình thành kích thước hạt. Với môi trường chế tạo càng acid thì kích thước hạt chitosan-TPP càng lớn. Hình 3. Ảnh DLS của hạt chitosan-TPP tại môi trường chế tạo pH = 3,5 (A) và pH = 5 (B) ở nồng độ chitosan 1 mg/mL, tỉ lệ khối lượng chitosan: STPP là 4:1. Ảnh hưởng của nồng độ chitosan tới phân bố kích thước hạt Thực hiện khảo sát tại các nồng độ chitosan 0,5; 1; 2 và 4 mg/mL, tại pH = 3,5 và tỉ lệ khối lượng chitosan: STPP là 6:1. Dung dịch hạt chitosan-TPP ở điều kiện này được kiểm tra bằng DLS (Hình 4). Khi nồng độ chitosan càng tăng thì kích thước hạt chủ yếu càng lớn, phân bố có xu hướng đồng đều hơn. Ở nồng độ chitosan 0,5 mg/mL kích thước chủ yếu là 165 nm, ở nồng độ 1 mg/mL là 280 nm, ở nồng độ 2 mg/mL là 600 nm và 4 mg/mL là 1,5 μm. Bởi vì mật độ chitosan hiện diện trong dung dịch càng lớn thì khả năng kết hợp nhiều chuỗi chitosan với tác nhân liên kết ngang càng cao làm cho hạt càng lớn, nồng độ chitosan lớn cũng làm cho việc tạo hạt trở nên dễ dàng hơn và hạt từ đó cũng đồng đều hơn. Ảnh hưởng của tỉ lệ khối lượng chitosan: STPP tới phân bố kích thước hạt Thực hiện khảo sát tại các tỉ lệ khối lượng giữa chitosan và STPP là 2:1; 4:1; 6:1 và 8:1 tại môi trường pH = 3,5 và nồng độ chitosan là 1 mg/mL (Hình 5). Khi thay đổi tỉ lệ khối lượng giữa chitosan và STPP thì kích thước hạt chủ yếu được tạo thành không có sự thay đổi lớn. Tại cả ba điều kiện 4:1, 6:1 và 8:1 đều có kích thước hạt chủ yếu ở 150 tới 200 nm. Nhưng việc thay đổi tỉ lệ khối lượng giữa polymer và tác nhân liên kết ngang lại ảnh hưởng lớn tới phân bố kích thước hạt. Khi tỉ lệ (A) (B) Science & Technology Development, Vol 18, No.T4-2015 Trang 130 lượng STPP sử dụng càng lớn thì kích thước hạt càng có xu hướng đồng đều hơn nhưng tới khi tỉ lệ khối lượng giữa chitosan và STPP đạt tới 2:1 thì chitosan tạo gel với ion TPP. Chitosan là một polymer mạch thẳng, để tạo hạt thì các tác nhân liên kết ngang cần thời gian phân tán trong dịch chitosan, từ đó khi tăng nồng độ STPP lên thì kích thước tạo ra vẫn không thay đổi, nhưng khi lượng STPP vượt mức cần thiết thì những hạt chitosan đã tạo thành được gắn kết với nhau bằng tác nhân tạo liên kết ngang dư thừa, sinh ra hiện tượng gel tụ. Hình 5. Ảnh DLS của hạt chitosan-TPP ở các tỉ lệ khối lượng chitosan:STPP là 8:1 (A); 6:1 (B) và 4:1 (C) trong điều kiện môi trường pH = 3,5, nồng độ chitosan là 1 mg/mL. (A) (B) Hình 4. Ảnh DLS của hạt chitosan ở nồng độ của chitosan 0,5 (A), 1 (B), 2 (C), 4 (D) mg/mL tại pH = 3,5 và tỉ lệ khối lượng chitosan: STPP là 6:1. (A) (B) (C) (C ) (D) TAÏP CHÍ PHAÙT TRIEÅN KH&CN, TAÄP 18, SOÁ T4- 2015 Trang 131 Phổ FTIR của hạt nano chitosan-TPP tải insulin Hình 6. Phổ FTIR của insulin người (A), chitosan (B), hạt nano chitosan-TPP (C) và hạt nano chitosan-TPP tải insulin (D). Sau khi thực hiện đo phổ FTIR của một số vật liệu liên quan và hạt nano chitosan-TPP tải insulin (Hình 6) từ đó có một số đánh giá như sau: so sánh phổ FTIR của hạt chitosan-TPP (C) và hạt chitosan-TPP tải insulin (D) nhận thấy không có sự khác biệt đáng kể nào giữa hai phổ, ở đó vẫn có sự tách đỉnh 1609 cm-1 của liên kết - NH2 trong chitosan (phổ B) thành 2 đỉnh ở 1630 cm -1 và 1530 cm -1. Đối với phổ của insulin (phổ A) có xuất hiện các đỉnh phổ thể hiện liên kết có trong protein, dải amide II ở 1656 cm-1 và dải amide III ở 1534 cm-1 nhưng cả hai đỉnh phổ này đều rất gần với các đỉnh phổ thể hiện tương tác giữa chitosan và tác nhân liên kết ngang nên không thể khẳng định trong phổ đã thể hiện liên kết của insulin. Nhưng ở vùng số sóng 500-750 cm -1 và vùng 3750-4000 cm -1 lại thể hiện được các đỉnh phổ nhỏ có trên insulin. Để có thêm bằng chứng cho việc insulin có tồn tại hay không trong hạt nano chitosan-TPP chế tạo được, chúng tôi thực hiện kiểm tra hiệu suất bao gói insulin của hạt nano chitosan với hai mục đích: khẳng định hạt nano chitosan-TPP có tải insulin thông qua sự chênh lệch giữa nồng độ ban đầu cho vào và nồng độ insulin tự do sau khi tạo hạt; tính được hiệu quả tải thuốc của hạt nano chitosan- TPP tại điều kiện chế tạo đã xác định. Tính chất hạt nano chitosan-TPP tải insulin Hạt nano chitosan-TPP (hạt kiểm chứng) và hạt nano chitosan-TPP tải insulin được chế tạo ở nồng độ chitosan là 1 mg/mL, tỉ lệ khối lượng giữa chitosan:STPP là 4:1 và thực hiện chế tạo trong môi trường pH = 3,5. Science & Technology Development, Vol 18, No.T4-2015 Trang 132 Hình 7. Ảnh DLS hạt chitosan-TPP không tải insulin (A), hạt chitosan-TPP tải insulin (B). Dựa trên kiểm tra phân bố hạt bằng DLS và hình ảnh, kích thước hạt bằng TEM nhận thấy rằng kích thước hạt chủ yếu xác định bằng DLS và kích thước hạt xác định bằng TEM có độ chênh lệch khá lớn. Theo ảnh DLS (Hình 7) cho thấy kích thước hạt chủ yếu với mẫu hạt nano không tải insulin (ảnh A) và hạt nano có tải insulin (ảnh B) chênh lệch không nhiều, ở đó hạt nano tải insulin có kích thước chủ yếu lớn hơn khoảng vài nanomet nhưng độ phân bố hạt rộng hơn kéo dài từ khoảng 70 nm tới 2 μm, với hạt có kích thước lớn hơn 1 μm chiếm khoảng hơn 10 %. Tuy nhiên đối với ảnh TEM (Hình 8) có thể thấy rằng kích thước hạt nano chitosan tải insulin lớn nhất cũng chưa đạt tới 100 nm (Hình 8B’) và hạt nano chitosan không tải thì không có hình dạng hạt (Hình 8A’). Từ đó thấy rằng, hạt nano chitosan là một hạt khá mềm và nhạy cảm với tác nhân vật lý mạnh như lực (kiểm chứng trong quá trình chế tạo), cường độ ánh sáng mạnh, nhiệt độ cao (kiểm chứng trong việc đo TEM mẫu chitosan không tải bị phân hủy), khi hạt nano chitosan thực hiện tải insulin được gia cố liên kết thì có xu hướng bền vững hơn. Hình 8. Ảnh TEM của hạt chitosan-TPP không tải insulin (A’) và hạt chitosan-TPP tải insulin (B’). Dung dịch hạt nano chitosan-TPP tải insulin sau khi được chế tạo và xử lý bằng túi thấm tách cellulose, trích mẫu ngoài túi thấm tách để đo DLS tại bước sóng 276 nm để xác định được lượng insulin tự do có trong dung dịch ban đầu được trích ra từ bên ngoài túi thấm, từ đó tính được lượng insulin tự do trong dung dịch chế tạo ban đầu với hiệu suất tải thuốc đạt 91,6 % tại môi trường pH = 3,5, nồng độ chitosan 1 mg/mL, tỉ lệ khối lượng giữa chitosan và STPP là 4:1 với nồng độ cuối của insulin là 50 μg/mL. (a’) (b’) (A) (B) TAÏP CHÍ PHAÙT TRIEÅN KH&CN, TAÄP 18, SOÁ T4- 2015 Trang 133 KẾT LUẬN Dựa trên phân tích phổ FTIR của chitosan trước và sau khi tái deacetyl hóa cũng như việc xác định độ deacetyl hóa bằng phương pháp phổ FTIR, đều khẳng định quá trình tái deacetyl diễn ra thành công, với độ deacetyl hóa ban đầu chỉ khoảng 75 % đã lên được 85 % - 90 % sau khi thực hiện tái deacetyl hóa. Tại điều kiện môi trường pH = 3,5, nồng độ chitosan đạt 1 mg/mL, tỉ lệ khối lượng giữa chitosan và STPP là 4:1 cho độ phân bố kích thước hạt tốt nhất (theo DLS), cũng ở điều kiện này thực hiện tải insulin tại nồng độ insulin là 50 μg/mL cho hiệu suất tải là 91,6 %, kích thước hạt nhỏ hơn 100 nm, hình dạng khá tròn. Dựa trên phân tích phổ FTIR và lượng insulin đã được tải lên tới 91,6 %, cho thấy quá trình chế tạo hạt nano chitosan-TPP tải insulin đã thành công. Preparation of insulin loaded chitosan- TPP nanoparticles by ionic gelation method Dinh Thi Huyen Trang Nguyen Duc Hao Le Van Hieu University of Science, VNU-HCM Ho Thanh Ha Laboratory for Nanotechnology (LNT), VNU-HCM ASTRACT In study, insulin loaded chitosan nanoparticles were prepared via ionic gelation method using cross-linking agent sodium tripolyphosphate (STPP). To have best result for the preparation of nanoparticles, a commercial chitosan with a degree of deacetylation DD of 75 % was adjusted to 85 % - 90 % which was determined by FTIR method. The obtained deacetylated chitosan was studied for the effect of pH, concentration, ratio of chitosan and STPP. Then the insulin loaded chitosan TPP nanoparticles were prepared by ionic gelation method. These nanoparticles could deliver 91.6 % insulin at pH = 3.5, with the chitosan concentration of 1 mg/mL and the chitosan:STPP ratio of 4:1. The TEMs indicate that chitosan nanoparticles were spherical in shape and the particles size was smaller than 100 nm. Investigation of FTIR and entrapment efficiency assert that insulin loaded chitosan nanopartiles have been prepared and can become a drug delivery system via oral in the future. Key words: chitosan nanoparticles, sodium tripolyphosphate, ionic gelation method, insulin. Science & Technology Development, Vol 18, No.T4-2015 Trang 134 TÀI LIỆU THAM KHẢO [1]. C.K.S. Pillai et al., Chitin and chitosan polymer: Chemistry, solubility and fiber formation, Progress in Polymer Science, 34, 641 – 678 (2009). [2]. M. Malhotra et al., A novel method for synthesizing PEGylated chitosan nanoparticles strategy, preparation, and in vitro and analysis, International Journal of Nanomedicine, 6, 485 – 494 (2011). [3]. W. Tiyahoonchai et al., Chitosan nanoparticles: A promising system for drug delivery, Navesuan University Journal, 11, 51 – 66 (2003). [4]. K.C. Gupta et al., Effect of molecular weight and degree of deacetylation on controlled release of isoniazide from chitosan microspheres, Polymer for Advanced Technologies, 19, 432 – 441 (2008). [5]. S.R. Jocshi et al., Insulin – history, biochemistry, physiology and pharmacology, Supplement of Japi, 55, 19 – 25 (2007). [6]. S. Royatrand et al., Determination of insulin concentration in Camel Milk using Ultra Violet-Visible Absorption Spectroscopy, J. FBT. IAU, 3, 53 – 60 (2013). [7]. H.J. Malmiri et al., Potential applications of chitosan nanoparticles as novel support in enzyme immobilization, American Journal of Biochemistry and Biotechnology, 8, 203 – 219 (2012). [8]. M.L. Tsaih et al., The effect of reaction time and temperature during heterogenous alkali deacetylation on degree deacetylation and molecular weight of resulting chitosan, Journal of Aplied Polymer Science, 8, 2917 – 2923 (2003). [9]. D.N. Mohammadpour et al., Preparation and in vitro characterization of chitosan nanoparticles containing Mesobuthus eupeus scorpion venom as an antigen delivery system, J Venom Anim Toxins Incl. Trop. Dis., 1, 44 – 52 (2012). [10]. Y. Wu et al., Chitosan nanoparticles as a novel delivery system for ammonium glycyrrhizinate, International Journal of Pharmaceutic, 295, 235 – 245 (2005). [11]. R.C. Biskup et al., Determination of degree of deacetylation of chitosan – comparision of method. Progress on Chemistry and Application of Chitin and Its. 17, 5 – 20 (2012).
File đính kèm:
 che_tao_hat_nano_chitosan_tpp_tai_insulin_bang_phuong_phap_t.pdf
che_tao_hat_nano_chitosan_tpp_tai_insulin_bang_phuong_phap_t.pdf

