Bài giảng Vật lý đại cương A2 - Chương 7: Vật lý nguyên tử
Nguyên tử hydro
1.Chuyển động của electron trong nguyên tử
hydro
Nguyên tử hidro gồm hạt nhân mang điện tích
+e và một electron mang điện tích –e. Kết quả
nghiên cứu chuyển động của electron trong
nguyên tử hydro có thể đem áp dụng cho các ion
đồng dạng như ion He+ , Li++ v.v vì trong các
ion đó chỉ còn một electron. Vì hạt nhân nặng
hơn electron nhiều nên ta sẽ bỏ qua chuyển
động của hạt nhân.
Chọn hạt nhân làm gốc O của hệ tọa độ. Gọi r
là khoảng cách từ electron đến hạt nhân
Giải thích sự cấu tạo vạch của nguyên tử hydro
Khi không có kích thích bên ngoài, electron bao
giờ cũng ở trạng thái ứng với mức năng lượng
thấp nhất E1 . Dưới tác dụng của kích thích bên
ngoài, electron thu năng lượng và nhảy lên mức
năng lượng En cao nào đó. Trạng thái ứng với
mức năng lượng En gọi là trạng thái kích thích.
Electron ở trạng thái kích thích trong thời gian
ngắn (~10-8 s) sau đó lại trở về trạng thái năng
lượng Em thấp hơn và nó sẽ phát xạ năng lượng
dưới dạng bức xạ điện từ nghĩa là phát ra một
photon có năng lượng hν

Trang 1

Trang 2

Trang 3

Trang 4

Trang 5

Trang 6
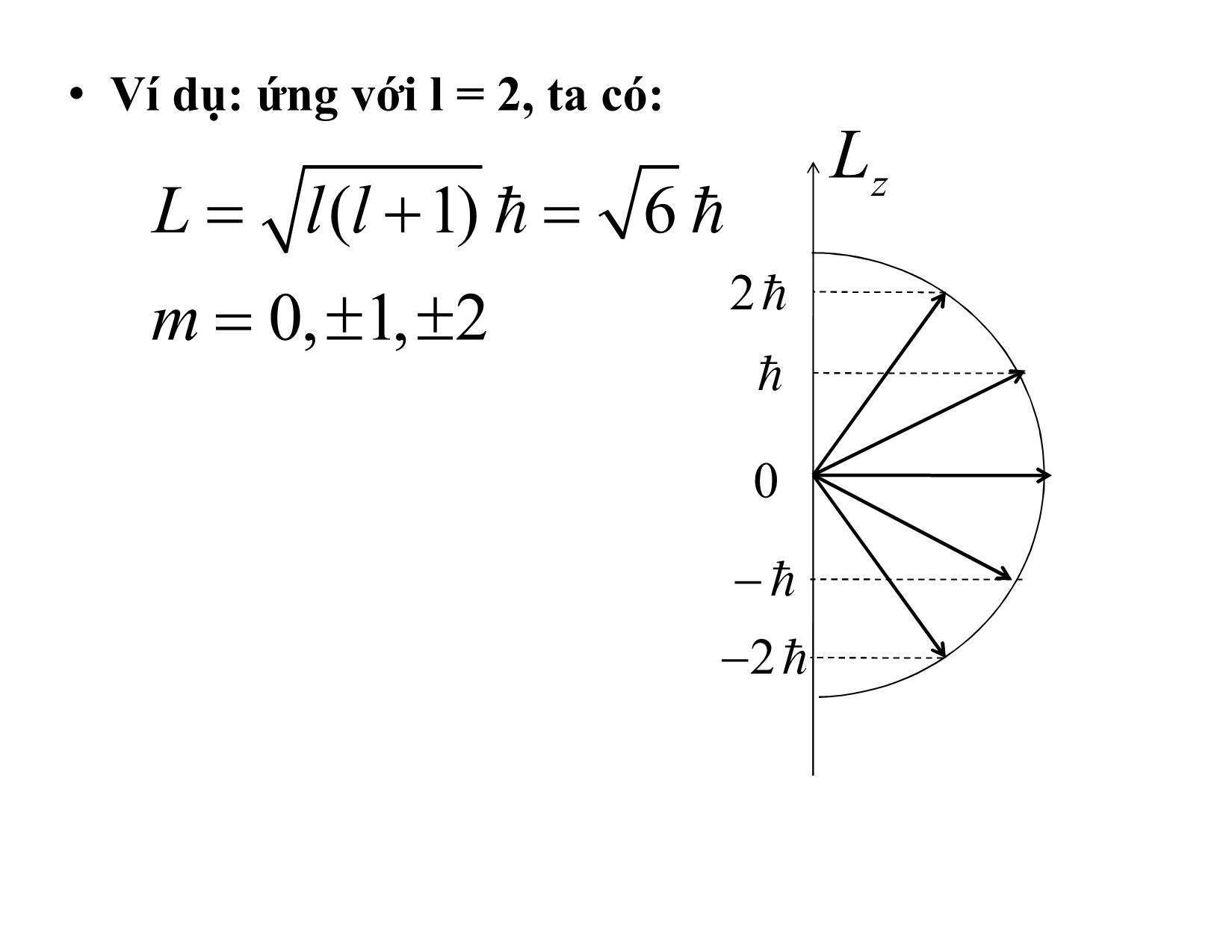
Trang 7

Trang 8

Trang 9

Trang 10
Tải về để xem bản đầy đủ
Tóm tắt nội dung tài liệu: Bài giảng Vật lý đại cương A2 - Chương 7: Vật lý nguyên tử

CHƯƠNG VII VẬT LÝ NGUYÊN TỬ I. Nguyên tử hydro 1.Chuyển động của electron trong nguyên tử hydro Nguyên tử hidro gồm hạt nhân mang điện tích +e và một electron mang điện tích –e. Kết quả nghiên cứu chuyển động của electron trong nguyên tử hydro có thể đem áp dụng cho các ion đồng dạng như ion He+ , Li++ v.vvì trong các ion đó chỉ còn một electron. Vì hạt nhân nặng hơn electron nhiều nên ta sẽ bỏ qua chuyển động của hạt nhân. Chọn hạt nhân làm gốc O của hệ tọa độ. Gọi r là khoảng cách từ electron đến hạt nhân Thế năng tương tác giữa hạt nhân và electron: Ze2 U 2 4 or PT Schrodinger có dạng: 2 2me Ze 2 E 0 4 or Các số lượng tử xuất hiện trong quá trình giải phương trình trên: a. Số lượng tử chính n : Các mức năng lượng của nguyên tử hidro phụ thuộc vào số lượng tử chính n 2 2 me Ze 1 En 2 n 1,2,3,.... 2 4 0 n Đối với nguyên tử hydro Z = 1 nên: 2 2 me e 1 Rh 13,6 En 2 2 2 eV 2 4 0 n n n R = 3,27.1015 s-1 gọi là hằng số Ritbe b. Số lượng tử quỹ đạo l: Electron chuyển động quanh hạt nhân nên có momen động lượng quỹ đạo L , số lượng tử l xác định độ lớn L L l( l 1) l 0,1,2,3,...., n 1 l gọi là số lượng tử orbital. Ký hiệu số lượng tử l: l = 0, 1, 2, 3, Ký hiệu = s, p, d, f, c. Số lượng tử từ quỹ đạo m: Hình chiếu của momen động lượng orbital L lên một phương z bất kỳ luôn được xác định theo hệ thức: Lz m m 0, 1, 2, 3,...., l m gọi là số lượng tử từ . • Ví dụ: ứng với l = 2, ta có: L L l( l 1) 6 z m 0, 1, 2 2 0 2 2. Các kết luận: a) Năng lượng của electron trong nguyên tử hydro bị lượng tử hoá. Trong vật lý nguyên tử mức năng lượng E1 (n = 1) gọi là mức K, E2 (n = 2) gọi là mức L, E3 (n = 3) gọi là mức M, E4 (n = 4) gọi là mức N, v.v • b) Năng lượng ion hoá của nguyên tử hidro Là năng lượng cần thiết đưa electron chuyển dời từ mức E1 lên mức E = 0 13,6eV E 0 2 13,6 eV 1 Giá trị này phù hợp với thực nghiệm c) Giải thích sự cấu tạo vạch của nguyên tử hydro Khi không có kích thích bên ngoài, electron bao giờ cũng ở trạng thái ứng với mức năng lượng thấp nhất E1 . Dưới tác dụng của kích thích bên ngoài, electron thu năng lượng và nhảy lên mức năng lượng En cao nào đó. Trạng thái ứng với mức năng lượng En gọi là trạng thái kích thích. Electron ở trạng thái kích thích trong thời gian ngắn (~10-8 s) sau đó lại trở về trạng thái năng lượng Em thấp hơn và nó sẽ phát xạ năng lượng dưới dạng bức xạ điện từ nghĩa là phát ra một photon có năng lượng hν Theo định luật bảo toàn năng lượng: Rh Rh En E m h nm 2 2 h nm n m 1 1 nm R 2 2 m n Khi m = 1 ta được các vạch phổ trong dãy Lyman , các vạch này nằm trong vùng tử ngoại 1 1 n1 R 2 2 ; n 2,3,4... 1 n Khi m =2 ta được các vạch phổ trong dãy Balmer, các vạch này nằm trong vùng ánh sáng nhìn thấy và một phần nằm trong vùng tử ngoại 1 1 n2 R 2 2 ; n 3,4,5,6 2 n Khi m =3 ta được các vạch phổ trong dãy Paschen 1 1 n3 R 2 2 ; n 4,5,6 3 n Khi m =4 ta được các vạch phổ trong dãy Brackett 1 1 n4 R 2 2 ; n 5,6,7... 4 n Khi m=5, n =6,7,8: các vạch nằm trong dãy Pfund. Các dãy Paschen, Brackett nằm trong vùng hồng ngoại d) Khi giải phương trình Schroedinger ta thu được hàm sóng phụ thuộc vào ba số lượng tử n, l, m.Vì U có tính đối xứng cầu nên ta giải bài toán này trong hệ tọa độ cầu . Như vậy hàm sóng sẽ là hàm của các biến số này: r,, nlm (,,)()(,)r R nl r Y lm • Mối liên hệ giữa hệ toạ độ Descartes và toạ độ cầu: x rsin .cos ; y r sin .sin ; z r cos z • Và yếu tố thể tích: dV dxdydz r 2 O rsin drd d y x Hàm sóng: nlm R nl()(,) r Y lm • Rnl () r là phần phụ thuộc khoảng cách của hàm sóng, nó phụ thuộc vào hai số lượng tử n,l. • Ylm (,) là phần phụ thuộc góc của hàm sóng, nó phụ thuộc vào hai số lượng tử l,m. • Một số dạng cụ thể của Rn,l và Yl,m 3/2 Zr Z a0 R1,0 ( r ) 2 e a0 3/2 Zr 1 Z Zr 2a0 R2,0 ( r ) 2 e 8 a0 a 0 3/2 Zr 1 Z Zr a0 R2,1() r e 24 a0 a 0 Còn đối với phần góc của hàm sóng 1 3 YY ; cos 004 10 4 3 Y sin e i 1, 1 8 3 Y sin ei 1, 1 8 4 2 0 a 0 0,53 : Là bán kính Bo 0 2 A me e e) Mật độ xác suất : Xác xuất tìm electron trong một yếu tố thể tích dV là: 2 dP nlm dV 2 2 Rnl( r ) Y lm ( , ) r sin drd d Phần chỉ phụ thuộc khoảng cách: 2 2 dPr R nl()() rrdr P nl rdr Pnl () r là mật độ xác xuất theo khoảng cách Ví dụ : hàm sóng của electron trong nguyên tử hydro ở trạng thái n = 1, l = 0, m = 0 có dạng: 3/2 1 r/ a0 1 100 R 10 Y 00 2 e . a0 4 Tìm khoảng cách ứng với xác suất lớn nhất. Giải: Mật độ xác suất theo khoảng cách có dạng : 2 24 2r / ao 2 P10()(). r R 10 r r 3 e r ao dP10 () r 4 2r / ao r 3 e. 1 2 r dr ao a o Cho đạo hàm bằng không, ta có: -10 r = ao = 0,53.10 m. Vậy tại khoảng cách ... y biến.Vậy bậc suy biến của mức năng lượng thứ n là n2 (chú ý ở đây chưa tính đến spin sẽ nói sau) III. Nguyên tử kim loại kiềm Các nguyên tử kim loại kiềm như Li, Na, là những nguyên tử có cấu tạo tương tự nguyên tử hidro, vỏ ngoài cùng của chúng chỉ có một electron hoá trị. + + + H Li Na Electron hoá trị này liên kết yếu với phần còn lại của nguyên tử gồm hạt nhân và các electron còn lại, vì vậy có thể xem nó chuyển động trong trường Coulomb gây bởi hạt nhân và các electron còn lại. Năng lượng của electron hóa trị trong nguyên tử kim loại kiềm có sai khác đôi chút với năng lượng electron trong nguyên tử hydro bởi vì ngoài năng lượng tương tác với hạt nhân còn có năng lượng tương tác với các electron khác trong nguyên tử. Khi giải phương trình Schroedinger khi tính thêm năng lượng phụ này, năng lượng electron hoá trị cũng bị lượng tử hoá, nhưng phụ thuộc vào hai số lượng tử n và l Rh13,6 eV Enl 2 2 ()()n xl n x l n là số lượng tử chính, xl là số hiệu chỉnh phụ thuộc vào số lượng tử l. Do năng lượng của electron trong kim loại kiềm phụ thuộc vào hai số lượng tử, nên ký hiệu các mức năng lượng là nX với n = 1,2,3,còn X = S khi l = 0 X = P khi l = 1 X = D khi l = 2 X = F khi l = 3 Việc chuyển mức phải tuân theo qui tắc: l 1 Ví dụ: xét nguyên tử Li gồm 3 electron, 2 electron gần hạt nhân chiếm mức năng lượng 1S, còn electron hoá trị khi chưa bị kích thích chiếm mức năng lượng 2S là mức thấp nhất. Theo qui tắc lựa chọn, electron ở mức cao chuyển về mức 2S (l =0) chỉ có thể là mức nP (l =1, n =2,3,4,), về mức 2P (l =1) chỉ có thể là mức nS (l = 0, n =3,4,) hay mức nD (l =2 và n = 3, 4,) Tần số bức xạ điện từ phát ra tuân theo công thức: a) Dãy chính: gồm các vạch tuân theo công thức: 2S nP b) Dãy phụ II: gồm các vạch tuân theo công thức: 2P nS c) Dãy phụ I: gồm các vạch tuân theo công thức: 2P nD d) Dãy cơ bản: gồm các vạch tuân theo công thức 3D nF 4F l 3 4D 4P l 2 n 4 4S l 1 l 0 3D Dãy cơ bản 3P l 2 3S n 3 l 1 l 0 2P Dãy phụ II Dãy phụ I l 1 n 2 l 0 2S Dãy chính Sơ đồ các mức năng lượng của Liti 4. Trong một chuyển dời về trạng thái kích thích với năng lượng 10,19 eV, một nguyên tử hydro phát ra một photon có o bước sóng 4890 A . Tìm năng lượng liên kết ở trạng thái đầu. Năng lượng photon phát ra: hc 6,625.10 34 .3.10 8 2,54eV 4890.10 10 Năng lượng kích thích là năng lượng (Ex ) cần tốn để đưa một nguyên tử từ trạng thái cơ bản (E1 ) lên trạng thái với năng lượng En cao hơn. En = E1 + Ex = -13,6 + 10,19 = -3,41 eV Gọi Eu là năng lượng của trạng thái đầu, ta có h Eu E n E u h E n 2,54 3,41 0,87 eV Vậy năng lượng liên kết của trạng thái đầu là 0,87 eV 6. Electron trong nguyên tử hidro ở trạng thái 1s. a) Tính xác xuất w1 tìm electron trong hình cầu (0 ; a) với a là bán kính Bo thứ nhất. b) Tính xác xuất w2 tìm electron ngoài hình cầu đó. Cho hàm sóng của electron ở trạng thái 1s là r 1 e ao 100 3 ao Ví dụ: 1. Năng lượng liên kết của electron hóa trị trong nguyên tử Liti ở trạng thái 2s bằng 5,59eV; ở trạng thái 2p bằng 3,54eV. Tính các số bổ chính Rytbe đối với các số hạng quang phổ s và p 1. Theo đề bài: 13,6 2 5,59 xs 0,44 (2 xs ) 13,6 2 3,54 xp 0,04 (2 xp ) 1. Tìm bước sóng của các bức xạ phát ra khi nguyên tử Na chuyển trạng thái 4s 3s cho biết các số bổ chính Rytbe đối với nguyên tử Li: xs = -1,37 ; xp = -0,9 Vì không thể có sự chuyển trạng thái trực tiếp từ 4S 3S (do vi phạm qui tắc chọn lựa) nên sự chuyển trạng thái đó thực hiện như sau: • Đầu tiên 4S 3P c 1 1 R 2 2 (3 0,9) (4 1,37) 0 10990 A • Tiếp theo 3P 3S c 1 1 R 2 2 (3 1,37) (3 0,9) 0 6079 A • Bước sóng của vạch cộng hưởng của nguyên tử Kali ứng 0với sự chuyển tiếp A 4p 4s bằng 7665 ; bước sóng0 giới hạn của dãy chính bằng 2858 A . Tính các số bổ chính Rytbe xs và xp đối với Kali • Theo đề bài 13,6.1,6.10 19 hc 2 (4 xs ) gh 6,625.10 34 3.10 8 x 2,23 2858.10 10 s 1 1 hc 13,6.1,6.10 19 2 2 (4 xs ) (4 x p ) ch 6,625.10 34 3.10 8 x 1,915 7665.10 10 p III. Sự lượng tử hoá của momen động lượng và momen từ. Hiệu ứng Zeeman thường 1. Momen động lượng Tương tự như trong cơ học cổ điển, electron chuyển động xung quanh hạt nhân nên có momen quỹ đạo (động lượng) L , nhưng vì electron chuyển động quanh hạt nhân không theo quỹ đạo xác định do đó ở mỗi trạng thái L không có hướng xác định. Tuy nhiên giá trị của nó lại xác định. CHLT đã chứng tỏ, giá trị này là: L l( l 1) , ( l 0,1,2,..., n 1) 2.Momen từ: Sự lượng tử hoá các mức năng lượng của nguyên tử hidro đã được thực nghiệm xác định vì nó đã cho bước sóng chính xác của các vạch phổ của nguyên tử hidro. Việc kiểm tra sự lượng tử hoá của momen động lượng sẽ được xác định thông qua việc kiểm chứng sự lượng tử hoá của momen từ bằng thực nghiệm. Ta hãy dùng mẫu Bo để rút ra hệ thức giữa và L Điện tử chuyển động trên quỹ đạo của nguyên tử hidro tương đương với dòng điện có cường độ: e ev I T2 r r là bán kính quỹ đạo, v và T là vận tốc và chu kỳ của điện tử chuyển động trên quỹ đạo. Momen từ của điện tử: ev2 evr e IS r me vr 2 r 2 2 me e L me vr L 2me Vì và L ngược chiều nhau nên e L 2me Hình chiếu của momen từ lên một phương z bất kỳ: e e z L z m m B 2me 2 m e 24 B 9,27.10J / T : manheton Bo Hiện tượng lượng tử hoá của momen từ đã được thực nghiệm xác nhận qua hiện tượng Zeeman mà ta sẽ xét dưới đây. 3.Hiệu ứng Zeeman: là hiện tượng tách vạch quang phổ nguyên tử thành nhiều vạch sít nhau khi nguyên tử phát sáng đặt trong từ trường. Giải thích: Vì electron có momen từ nên khi nguyên tử hydro đặt trong từ trường nó có thêm năng lượng phụ: EB . Chọn z là phương của B ta có: E z B m B B Vậy năng lượng của electron khi nguyên tử hydro đặt trong từ trường: E' E mB B E là năng lượng của electron khi không có từ trường. Nếu electron dịch chuyển từ mức S ● N năng lượng E’2 sang mức năng lượng E’1 thấp hơn thì nó sẽ phát ra bức xạ điện từ. Tần số của vạch quang phổ bằng: Kính quang phoå EEEE'' m m B v ' 2 1 2 1 2 1 B h h h EE Nhưng 2 1 h 0 là tần số của vạch quang phổ hidro khi không có từ trường. Vậy: m m B v ' 2 1 B 0 h Qui tắc chọn lựa đối với m : m 0 , 1 • Vậy tần số có thể có 3 giá trị: l=1 E2 B=0 B B, 0 h E1 l=0 ', 0 E2 + µB m=+1 B B E m =0 0 h 2 E2 - µB m = -1 B 0 E1 m =0 Ví dụ: 1. Tính tất cả các góc có thể có của L tạo với trục z với l = 3 2. Tìm độ biến thiên của bước sóng của o vạch đỏ cađimi ( 6438 A ) do hiệu ứng Zeeman thông thường khi các nguyên tử đặt trong một từ trường 0,009T. • Ta có: 3 2 1 L l( l 1) 12 0 -1 -2 Lz m , m 0, 1, 2, 3 -3 L m cos z L 12 3 m 3 cos 300 12 2 m 2 cos 54,730 12 1 m 1 cos 73,220 12 m 0 cos 0 900 1 m 1 cos 106,780 12 2 m 2 cos 125,260 12 3 m 3 cos 1500 12 2. hc d 2 E E dE hc 2 hc e E B 5,21.10 7 eV 2m 2 E 0 1,74.10 3 A hc Khi một nguyên tử đặt trong từ trường 0,6T thì trong nguyên tử xảy ra những chuyển dời giữa các trạng thái l =2 và l =1. Tìm các bước sóng quan sát được, nếu khi không có từo trường thì bước sóng là 5000 A • Hiệu năng lượng giữa các mức: e E B 3,47.10 5 eV 2m 2 E 0 0,07 A hc • Các chuyển dời phải tuân theo qui tắc chọn lựa m 0, 1. Với 9 chuyển dời có thể xẩy ra chỉ có ba giá trị khác nhau của bước sóng 0 0 0 5000,07AAA ; 0 5000 ; 4999,93 m 2 1 l=2 0 -1 -2 0 0 0 1 l=1 0 -1 IV.Spin electron 1)Nhờ có dụng cụ quang phổ tinh vi, người ta phát hiện các vạch quang phổ không phải là các vạch đơn, mà gồm nhiều vạch rất sít nhau.Đặc điểm có các vạch sít nhau đó được gọi là cấu trúc bội của phổ. Để giải thích hiện tượng này, năm 1925 S.A.Goudsmitt và G.E.Uhlenbeck đã đề ra giả thuyết về spin của điện tử. Theo giả thuyết này thì ngoài momen động lượng quỹ đạo L , electron còn có momen động lượng riêng gọi là momen spin S và momen từ spin S CHLT chứng minh được: Hình chiếu của S trên trục z bằng: 1 S m , m z s s 2 m gọi là số lượng tử hình chiếu spin s S có giá trị : 3 S s( s 1) 4 s = 1/2 gọi là số lượng tử spin (gọi tắt là spin) e s S me Hình chiếu của nó lên trục z bằng: e e e sz S z m s B me m e2 m e b)Thí nghiệm Stern – Gerlach Đầu tiên trong thí nghiệm này người ta dùng chùm các nguyên tử bạc , sau đó là chùm các nguyên tử hidro, trong đó một chùm nguyên tử bạc với momen động lượng quỹ đạo bằng không đi qua một từ trường không đồng nhất bị tách thành hai phần chứa cùng một số nguyên tử dưới dạng hai vệt trên màn chắn nằm phía trên và phía dưới vệt bạc khi không có từ trường. S Ag N Chúng ta sẽ khảo sát thí nghiệm với nguyên tử hidro. Nguyên tử hidro ở trạng thái cơ bản, n = 1 nên l = 0 và m = 0. Tuy nhiên vì momen spin của electron là momen động lượng riêng nên nó không thể bằng không được. Và vì có momen spin của electron nên nguyên tử được xem là lưỡng cực từ bị lượng tử hoá. Nếu lưỡng cực từ được đặt trong từ trường không đều nó sẽ chịu tác dụng một lực dB F z z dz • Trong thí nghiệm của Stern-Gerlach, một chùm các nguyên tử có dạng một dãi mỏng đi qua một từ trường không đều tới một detctor. Ta có thể xét chùm này gồm hai chùm con, một gồm các electron có spin hướng lên và một gồm các electron có spin hướng xuống. Lực từ tác dụng lên hai chùm này có hướng ngược nhau. Khi đó một chùm sẽ lên phía trên và một chùm sẽ bị lệch xuống phía dưới. 2.Trạng thái và năng lượng của electron trong nguyên tử Momen toàn phần của electron: JLS Độ lớn của J là: J j( j 1) j là số lượng tử momen toàn phần được xác định bởi : 1 j l 2 Do có momen spin nên trạng thái của một electron trong nguyên tử được xác định bởi bốn số lượng tử: n, l, m, ms . • Với một giá trị xác định của mỗi mức năng lượng lại tách thành hai mức (trừ mức năng lượng S, l = 0): j = l + ½ ở cao hơn mức l – ½ . Khoảng cách giữa hai mức này không lớn lắm. Cấu trúc như vậy gọi là cấu trúc tế vi của mức Do có momen từ riêng nên có sự tương tác giữa momen từ riêng và momen từ quỹ đạo và giữa momen từ riêng của các electron trong nguyên tử. Như vậy có thêm năng lượng phụ bổ sung vào biểu thức tính năng lượng của electron. Phép tính chứng tỏ: Năng lượng toàn phần của electron trong nguyên tử phụ thuộc vào ba số lượng tử n, l, j. Trong vật lý nguyên tử, người ta ký hiệu mức năng lượng của electron: 2 n X j n = 1, 2, 3,(số lượng tử chính) X = S, P, D, Ftùy theo l = 0, 1, 2, 3, 1 j l 2 Số 2 chỉ cấu tạo bội kép của mức năng lượng. Còn trạng thái của electron hoá trị thì thường dùng : nxj Trước đây khi chưa tính đến ms, ứng với số lượng tử n có n2 trạng thái lượng tử khác nhau. Khi tính đến ms thì ứng với số lượng tử n sẽ có 2n2 trạng thái lượng tử khác nhau (vì ms có hai giá trị). Vậy bậc suy biến là 2n2 . 3.Cấu tạo bội của vạch quang phổ: Do năng lượng của electron còn phụ thuộc vào j, nên khi chuyển từ mức năng lượng cao sang mức năng lượng thấp hơn, electron phải tuân theo qui tắc lựa chọn: Đối với l : l 1 Đối với j: j 0, 1 Ví dụ: giải thích cấu tạo bội của vạch quang phổ đối với kim loại kiềm. 2 3 P3/2 3P 2 3 P1/2 2S 2 a) b) 2 S1/2 a) Vạch quang phổ khi chưa để ý tới spin b) Vạch kép khi để ý tới spin Khi chưa để ý đến spin, ta có một vạch đơn đối với tần số: 2SP 3 Nếu kể đến spin ta có vạch kép: 2 2 1 2S 1/2 3 P 1/2 ( l 1, j 0) 2 2 1 2S 1/2 3 P 3/2 ( l 1, j 1) 2 3 D5/2 3D 2 3 D3/2 22P 2P 3/2 22P a) b) 1/2 a) Vạch quang phổ khi chưa tính tới spin b) Vạch bội ba khi tính tới spin Khi chưa để ý đến spin, ta có một vạch đơn đối với tần số: 2PD 3 Khi kể tới spin ta có ba vạch sít nhau gọi là vạch bội ba 2 2 1 2P 1/2 3 D 3/2 ( l 1, j 1) 2 2 2 2P 3/2 3 D 3/2 ( l 1, j 0) 2 2 3 2P 3/2 3 D 5/2 ( l 1, j 1) V. Bảng hệ thống tuần hoàn Mendeleev Chúng ta giải thích sự phân bố các electron trong bảng tuần hoàn Mendeleev dựa trên hai nguyên lý: a) Nguyên lý Pauli: Ở mỗi trạng thái lượng tử xác định bởi 4 số lượng tử n, l, m, ms chỉ có thể tối đa một electron. b) Nguyên lý cực tiểu năng lượng. Dựa vào nguyên lý Pauli ta tính được số electron tối đa trong nguyên tử có cùng chung ba, hai và một số lượng tử: * Số electron có cùng chung 3 số lượng tử n, l, m tối đa là 2 vì số lượng tử ms 1/ 2 * Số electron có cùng chung hai số lượng tử n, l tối đa là 2(2l + 1), vì ứng với mỗi giá trị của l có thể nhận (2l + 1) giá trị khác nhau của m và ứng với mỗi giá trị của m có thể có hai giá trị của ms . * Số electron có cùng chung số lượng tử n tối đa là 2n2 vì n 1 2(2l 1) 2 n2 l 0 Như vậy, trong nguyên tử các electron được phân bố thành từng lớp ứng với cùng số lượng tử n. Trong một lớp lại chia thành lớp con phụ thuộc số lượng tử l Qui luật sắp xếp ở đây dựa vào nguyên lý cực tiểu năng lượng, nghĩa là các electron trước hết sẽ chiếm các mức năng lượng thấp nhất, sau đó mới đến các mức năng lượng cao hơn. Ví dụ: lớp L(n = 2) có tối đa 8 electron có 2 lớp con: - Lớp S(l = 0) có tối đa 2(2l + 1) = 2 electron - Lớp P(l = 1) có tối đa 6 electron Ví dụ: Trong nguyên tử, xác định số trạng thái electron thuộc lớp n (n = 3 và n = 4) có cùng những số lượng tử sau: a) Cùng ms b) cùng m = 1 c) cùng m = -1 và ms = -1/2 a) Cùng ms Vậy với n và ms xác định số trạng thái electron là l n 1 (2l 1) n2 l 0 n 3 n2 9 n 4 n2 16 b) Cùng m = 1 Khi n xác định và m xác định thì : m l l m, m 1..., n 1 Vậy khi n và m xác định thì có n m trạng thái của electron khác nhau bởi các giá trị của l và kết quả có 2( n m ) trạng thái electron khác nhau bởi các giá trị của l và ms m 1, n 3 2( n m ) 4 m 1, n 4 2( n m ) 6 c) Cùng m = -1 và ms = ½ Với n, m và ms xác định, có n m trạng thái electron khác nhau bởi các giá trị của l n 3, m 1 n m 2 n 4, m 1 n m 3 Ví dụ: Lớp n = 3 chứa đầy các electron. Tìm số electron: a) Có cùng số lượng tử ms = 1/2 b) Có cùng số lượng tử m = 1 c) Có cùng m = -2 d) Có cùng số lượng tử ms = -1/2 và m = 0 e) Có cùng số lượng tử ms = 1/2 và l = 2 a) Có cùng n và ms l n 1 (2l 1) n2 9 l 0 b) Có cùng n và m 2(n m ) 2(3 1) 4 c) 2(n m ) 2(3 2) 2 d) Cùng n,ms và m Trạng thái của electron khác nhau bởi các giá trị của l, l = 0, 1, ..,n-1. Vậy có n = 3 electron. e) Có cùng n, ms là l Trạng thái của electron khác nhau bởi các giá trị của m. Vậy số electron là: 2l + 1 = 5
File đính kèm:
 bai_giang_vat_ly_dai_cuong_a2_chuong_7_vat_ly_nguyen_tu.pdf
bai_giang_vat_ly_dai_cuong_a2_chuong_7_vat_ly_nguyen_tu.pdf

