Bài giảng Vật lý đại cương 2 - Chương 7: Vật lý nguyên tử - Phạm Thị Hải Miền
PHỔ NGUYÊN TỬ HYDRO
• Khi không có kích thích bên ngoài, electron nằm ở trạng thái ứng
với mức năng lượng thấp nhất E1 trạng thái bền.
• Dưới tác dụng của kích thích bên ngoài, electron sẽ thu được năng
lượng và nhảy lên mức năng lượng E’ nào đó (E’ >E1) trạng thái
kích thích.
• Electron chỉ ở trạng thái kích thích trong thời gian ngắn ( 108 s),
sau đó lại trở về trạng thái năng lượng thấp hơn và bức xạ ra photon .
• Theo định luật bảo toàn năng lượng, năng lượng photon phát ra khi
electron chuyển từ mức năng lượng cao En’ về mức năng lượng thấp
En
(với n’>n) bằng
NĂNG LƢỢNG ELECTRON TRONG NGUYÊN TỬ KLK
Với: l - số hiệu chính, phụ thuộc vào số lượng tử quĩ đạo l.
2. NGUYÊN TỬ KIM LOẠI KIỀM
• Nguyên tử KLK có Z electron quay quanh hạt nhân. Trong đó (Z-1)
electron bên trong và hạt nhân tạo thành một lõi điện tích +e, còn một
electron ngoài cùng gọi là electron hóa trị Tính chất hóa học của
KLK tương tự Hydro.
• Năng lượng của electron hóa trị của kim loại kiềm phụ thuộc vào cả
số lượng tử n và số lượng tử quĩ đạo l.

Trang 1

Trang 2

Trang 3

Trang 4

Trang 5

Trang 6

Trang 7

Trang 8
Trang 9

Trang 10
Tải về để xem bản đầy đủ
Tóm tắt nội dung tài liệu: Bài giảng Vật lý đại cương 2 - Chương 7: Vật lý nguyên tử - Phạm Thị Hải Miền

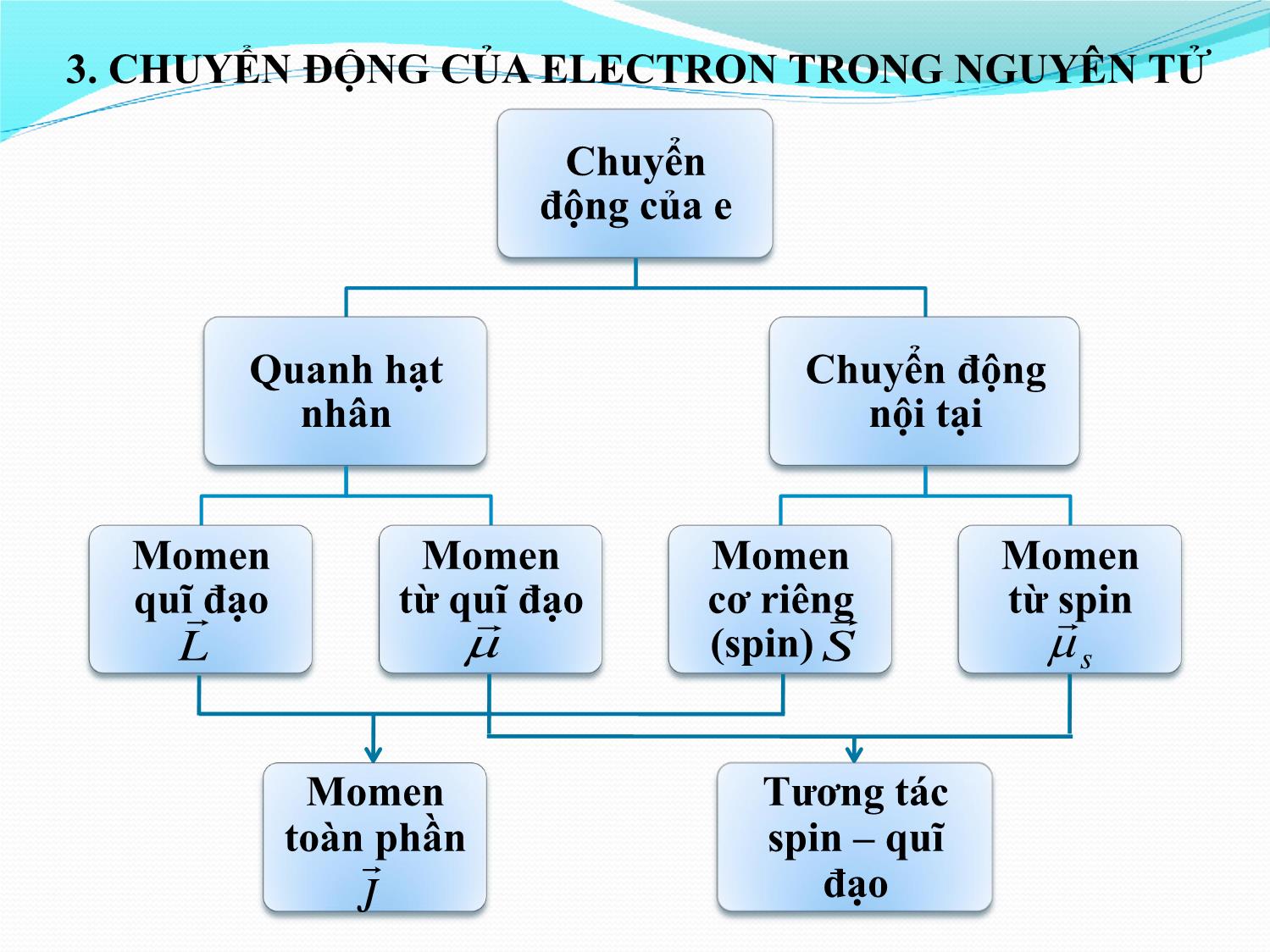
CHƢƠNG 7 VẬT LÝ NGUYÊN TỬ 1. NGUYÊN TỬ HYDRO 1.1. Phƣơng trình Schrödinger nguyên tử Hydro 1.2. Phổ nguyên tử Hydro 2. NGUYÊN TỬ KIM LOẠI KIỀM 2.1. Năng lƣợng electron trong nguyên tử KLK 2.2. Phổ nguyên tử KLK 3. CHUYỂN ĐỘNG CỦA ELECTRON TRONG NGUYÊN TỬ 3.1. Chuyển động của electron quanh hạt nhân 3.2. Chuyển động nội tại của electron 3.3. Momen toàn phần. Cấu trúc tế vi. 3.4. Trạng thái và năng lƣợng electron trong nguyên tử 1. NGUYÊN TỬ HYDRO 1.1. PHƢƠNG TRÌNH SCHRÖDINGER NGUYÊN TỬ HYDRO • Thế năng của electron khi chuyển động quanh hạt nhân: e2 U 4 or • Phương trình Schrödinger của electron: 2 2me e 2 E0 4 or • Nghiệm của phương trình: Hàm sóng: biểu diễn trạng thái lượng tử của electron n,l,m có dạng phức tạp, phụ thuộc vào 3 số lượng tử n, l ,m. me4 1 1 Năng lƣợng electron: E e E 13,6 ( eV ) n 2 2 2 n n2 80 hn n – số lượng tử chính (n = 1, 2, 3). l – số lượng tử quĩ đạo (l = 0, 1, 2,, n-1). m – số lượng tử từ (m = 0, 1, 2, , l). 1 E 13,6 ( eV ) n n2 Năng lượng của electron trong nguyên tử hydro phụ thuộc vào số (lớp M) nguyên n năng lượng bị lượng tử hóa. (lớp L) Mức năng lượng thấp nhất E1 (n=1) được gọi là mức năng lượng cơ bản. Các mức năng lượng lần lượt tăng theo thứ tự E2 < E3 < E4 Càng lên cao, các mức càng xích lại và khi n = , năng lượng biến thiên liên tục. (lớp K) 1.2. PHỔ NGUYÊN TỬ HYDRO • Khi không có kích thích bên ngoài, electron nằm ở trạng thái ứng với mức năng lượng thấp nhất E1 trạng thái bền. • Dưới tác dụng của kích thích bên ngoài, electron sẽ thu được năng lượng và nhảy lên mức năng lượng E’ nào đó (E’ >E1) trạng thái kích thích. • Electron chỉ ở trạng thái kích thích trong thời gian ngắn ( 10 8 s), sau đó lại trở về trạng thái năng lượng thấp hơn và bức xạ ra photon . • Theo định luật bảo toàn năng lượng, năng lượng photon phát ra khi electron chuyển từ mức năng lượng cao En’ về mức năng lượng thấp En (với n’>n) bằng: 4 mee 11 EEnn' 2 2 2 2 8'0 h n n • Tần số của photon (vạch quang phổ) được bức xạ ra là: 4 mee 1 1 1 1 2 3 2 2 R 2 2 h80 h n n ' n n ' 4 mee 15 1 Rs 23 3,29.10 - hằng số Rydberg 80 h • Khi n = 1, n’ = 2, 3, 4: dãy Lyman nằm trong vùng tử ngoại. • Khi n = 2, n’ = 3, 4, 5: dãy Balmer nằm trong vùng khả kiến. • Khi n = 3, n’ = 4, 5, 6: dãy Paschen nằm trong vùng hồng ngoại. • Bán kính quĩ đạo dừng thứ n của electron trong nguyên tử Hydro: 2 rn n r0 -11 r0 =0,53. 10 m - bán kính Bohr. BÀI TẬP VÍ DỤ 1 Trong một phân tích quang phổ phát xạ của nguyên tử Hydro người ta thấy có 3 vạch màu. Hỏi quang phổ phát xạ này có bao nhiêu vạch tất cả? Hƣớng dẫn giải • Ba vạch màu thuộc dãy Balmer ứng với sự chuyển mức năng lượng từ n=3,4,5 về n=2. • Tổng số bước chuyển có thể xảy ra: n=5 n=1,2,3,4. n=4 n=1,2,3. n=3 n=1,2. n=2 n=1. Có 10 vạch. 2. NGUYÊN TỬ KIM LOẠI KIỀM 2.1. NĂNG LƢỢNG ELECTRON TRONG NGUYÊN TỬ KLK • Nguyên tử KLK có Z electron quay quanh hạt nhân. Trong đó (Z-1) electron bên trong và hạt nhân tạo thành một lõi điện tích +e, còn một electron ngoài cùng gọi là electron hóa trị Tính chất hóa học của KLK tương tự Hydro. • Năng lượng của electron hóa trị của kim loại kiềm phụ thuộc vào cả số lượng tử n và số lượng tử quĩ đạo l. 1 Enl 13,6 2 eV n l Với: l - số hiệu chính, phụ thuộc vào số lượng tử quĩ đạo l. 2.2. PHỔ NGUYÊN TỬ KIM LOẠI KIỀM • Electron hóa trị trong nguyên tử KLK khi bị kích thích có thể chuyển mức năng lượng từ thấp lên cao và chuyển về sau khoảng thời gian ngắn. Tuy nhiên việc chuyển mức năng lượng phải tuân theo qui tắc chọn lọc. • Qui tắc chọn lọc 1: Electron trong nguyên tử chỉ có thể dịch chuyển giữa các mức năng lượng có Δl=±1. • Xét Liti 1s22s1: 2S-nP (n≥2) – dãy chính 2P-nS (n≥3) – dãy phụ II 2P-nD (n≥3) – dãy phụ I 3D-nF (n≥4) – dãy cơ bản 3. CHUYỂN ĐỘNG CỦA ELECTRON TRONG NGUYÊN TỬ Chuyển động của e Quanh hạt Chuyển động nhân nội tại Momen Momen Momen Momen quĩ đạo từ quĩ đạo cơ riêng từ spin L (spin) S s Momen Tƣơng tác toàn phần spin – quĩ J đạo 3.1. CHUYỂN ĐỘNG CỦA ELECTRON QUANH HẠT NHÂN a. Momen động lƣợng quĩ đạo (momen quĩ đạo). • Vì electron không có quĩ đạo nên momen động lượng không có hướng xác định. • Vectơ momen quĩ đạo L có các giá trị xác định: L l l 1 • Hình chiếu của vectơ lên một phương z bất kỳ: Lmz Với: l - số lượng tử quỹ đạo (l = 0, 1, 2, , n 1). m - số lượng tử từ (m = 0, 1, 2, , l) . Momen quĩ đạo và hình chiếu của nó bị lượng tử hóa. l = 1 m = 0, 1 l = 2 m = 0, 1, 2 , L 2 L 6 Lz 0, Lz 0, , 2 BÀI TẬP VÍ DỤ 2 Trong nguyên tử Hydro, electron đang ở trạng thái 3d. Tính góc nhỏ nhất mà vecto momen động lượng có thể lập với trục z. Hƣớng dẫn giải • Trạng thái 3d ứng với l=2 m = 0, 1, 2 L l l 16 Lmz 0, , 2 • Góc nhỏ nhất: 2 cos 350 6 b. Momen từ quĩ đạo (momen từ). • Electron quay quanh hạt nhân tạo thành một dòng điện i (có chiều ngược với chiều chuyển động của electron) dòng điện i có momen từ ngược chiều với momen quĩ đạo L . e L 2me • Hình chiếu của momen từ lên một phương z bất kỳ: ee zz L m m B 22mmee 22 2 Với: Be e 2 m 10 ( Am ) - magneton Bohr. Momen từ và hình chiếu của nó bị lượng tử hóa. • Qui tắc chọn lọc 2: Electron trong nguyên tử chỉ có thể dịch chuyển giữa các mức năng lượng có Δm=0, ±1. HIỆU ỨNG ZEEMAN • Khi nguyên tử ở trong một từ trường ngoài B, năng lượng của electron trở thành: E' E mB.B Với: E – năng lượng electron khi không có từ trường ngoài. • Nếu electron chuyển từ trạng thái E’2 sang trạng thái E’1 < E’2 thì nó sẽ phát ra một bức xạ điện từ có tần số: EEEE'' m m B m m B v' 2 1 2 1 2 1BB 2 1 h h h h Với: ν – tần số vạch quang phổ khi không có từ trường ngoài. • Theo qui tắc lựa chọn 2: Δm = m2 – m1= 0, ±1 ν’ có 3 giá trị Một vạch quang phổ tách thành ba vạch khi có từ trường ngoài. v B B h v' v v B B h 3.2. CHUYỂN ĐỘNG NỘI TẠI CỦA ELECTRON a. Momen cơ riêng (spin). • Ngoài chuyển động quanh hạt nhân, electron còn tham gia một chuyển động tự quay quanh trục riêng, đặc trưng bởi momen cơ riêng, gọi là spin S và lấy những giá trị gián đoạn: S s s 1 • Hình chiếu của momen spin lên phương z bất kì: S m z s 2 Với: s = 1/2 - số lượng tử spin. ms = 1/2 - số lượng tử hình chiếu spin tương ứng với 2 chiều quay ngược nhau của electron quanh trục riêng. b. Momen từ spin. • Ứng với momen quỹ đạo L , electron có momen từ quỹ đạo . Một cách tương tự, với momen cơ riêng spin S, electron có momen từ spin s . e s S me • Hình chiếu của trên trục z: e e sz Sz B me 2me 3.3. MOMEN TOÀN PHẦN • Momen toàn phần J của electron: J L S • Giá trị của momen toàn phần: J j j 1 1 Với: j l - số lượng tử toàn phần. 2 • Qui tắc chọn lọc 3: Electron trong nguyên tử chỉ có thể dịch chuyển giữa các mức năng lượng có Δj=0, ±1. CẤU TRÚC TẾ VI CỦA PHỔ NGUYÊN TỬ • Phổ của nguyên tử có những vạch rất gần nhau do sự tách các mức năng lượng gọi là cấu trúc tế vi. Chỉ có các máy quang phổ rất nhạy mới giúp phát hiện các vạch đó. • Giải thích: Với một giá trị l ta có hai giá trị j là: j l 1 2 và j l 1 2 (Trừ trường hợp mức S (l = 0) chỉ có một mức tương ứng j=1/2) Cấu trúc kép của vạch 2s – 3p Cấu trúc bội ba của vạch 2p – 3d 3.4. TRẠNG THÁI VÀ NĂNG LƢỢNG ELECTRON • Trạng thái lượng tử của electron đặc trưng bởi 4 số lượng tử (n, l, m, ms). • Nguyên lý Pauli: trong mỗi trạng thái lượng tử xác định bởi bốn số lượng tử (n, l, m, ms) chỉ có tối đa một electron. • Nguyên lý cực tiểu năng lƣợng: mọi hệ vật lý đều có xu hướng chiếm trạng thái có năng lượng cực tiểu gọi là trạng thái bền Các electron sẽ xếp đầy lớp K trước, sau đó mới đến lớp L, M • Với n đã cho có thể có tối đa 2n2 trạng thái lượng tử khác nhau, như vậy, có tối đa 2n2 electron ứng với mức n. • Trạng thái lượng tử của electron được biểu diễn bởi hàm sóng phụ thuộc vào 3 số lượng tử n, l, m: n,l,m . • Năng lượng electron trong nguyên tử phụ thuộc vào 3 số lượng tử n, l , j: En,l,j 2 • Trạng thái electron được ký hiệu nXj (X phụ thuộc l). Số e tối đa Số e tối đa n l m m s trong lớp trong phân lớp Lớp Phân lớp Orbital Spin = 2n2 = (2l+1) 1(K) 0 (s) 0 1/2 2 2 0 (s) 0 1/2 2 2 (L) 1 (p) -1 1/2 8 0 1/2 6 1 1/2 0 (s) 0 1/2 2 -1 1/2 1 (p) 0 1/2 6 1 1/2 3 (M) -2 1/2 18 -1 1/2 2 (d) 0 1/2 10 1 1/2 2 1/2 BÀI TẬP VÍ DỤ 3 Khi electron hóa trị trong nguyên tử chuyển từ mức 4D về 3P thì máy quang phổ có độ phân giải cao có thể phát hiện những vạch nào? Hƣớng dẫn giải • Trạng thái 4D ứng với l=2 j = 3/2, 5/2 • Trạng thái 3P ứng với l’=1 j’ = 1/2, 3/2 • Các bước chuyển phải theo qui tắc chọn lọc: Δl = ±1; Δj = 0, ±1 Có những bước chuyển sau: 22 1. j=3/2 j’=1/2 ~ 4D3/2 3 P 1/2 ( j 1) 22 2. j=3/2 j’=3/2 ~ 4D3/2 3 P 3/2 ( j 0) 22 3. j=5/2 j’=3/2 ~ 4D5/2 3 P 3/2 ( j 1)
File đính kèm:
 bai_giang_vat_ly_dai_cuong_2_chuong_7_vat_ly_nguyen_tu_pham.pdf
bai_giang_vat_ly_dai_cuong_2_chuong_7_vat_ly_nguyen_tu_pham.pdf

