Bài giảng Hóa học Lớp 9 - Bài 26: Clo
Dạng đơn chất :
Dạng hợp chất :
NaCl có trong nước biển, mỏ.
- KCl có trong quặng:
cacnalit KCl.MgCl2.6H2O
xinvinit KCl.NaCl
-Clo chiếm 0,05% khối lượng vỏ trái đất.
-Ngoài ra Clo còn có trong huyết thanh động vật, trong dạ dày (dạng HCl)
Độc : kích thích mạnh đường hô hấp và làm viêm các niêm mạc
d Cl2/kk = 71/29 ? nặng gấp 2,5 lần không khí
Ít tan trong nước, ở 200C 1 thể tích H2O hòa tan 2,3 thể tích Cl2, Clo tan nhiều trong dung môi hữu cơ : benzen (C6H6), cacbontetraclorua (CCl4)

Trang 1
Trang 2

Trang 3

Trang 4

Trang 5

Trang 6
Trang 7
Trang 8
Trang 9

Trang 10
Tải về để xem bản đầy đủ
Bạn đang xem 10 trang mẫu của tài liệu "Bài giảng Hóa học Lớp 9 - Bài 26: Clo", để tải tài liệu gốc về máy hãy click vào nút Download ở trên
Tóm tắt nội dung tài liệu: Bài giảng Hóa học Lớp 9 - Bài 26: Clo

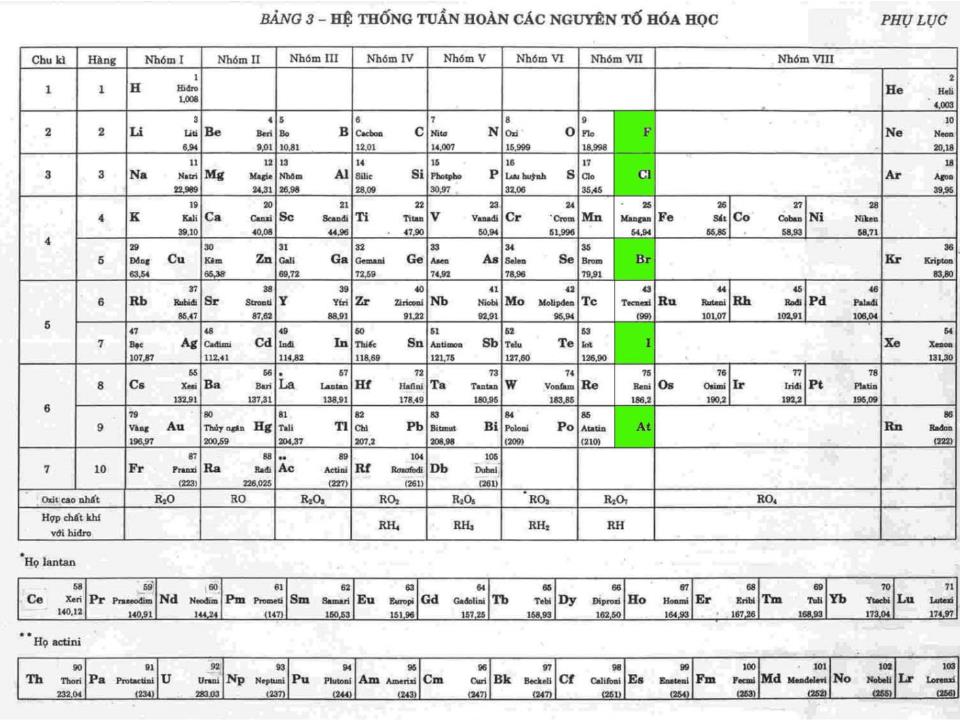
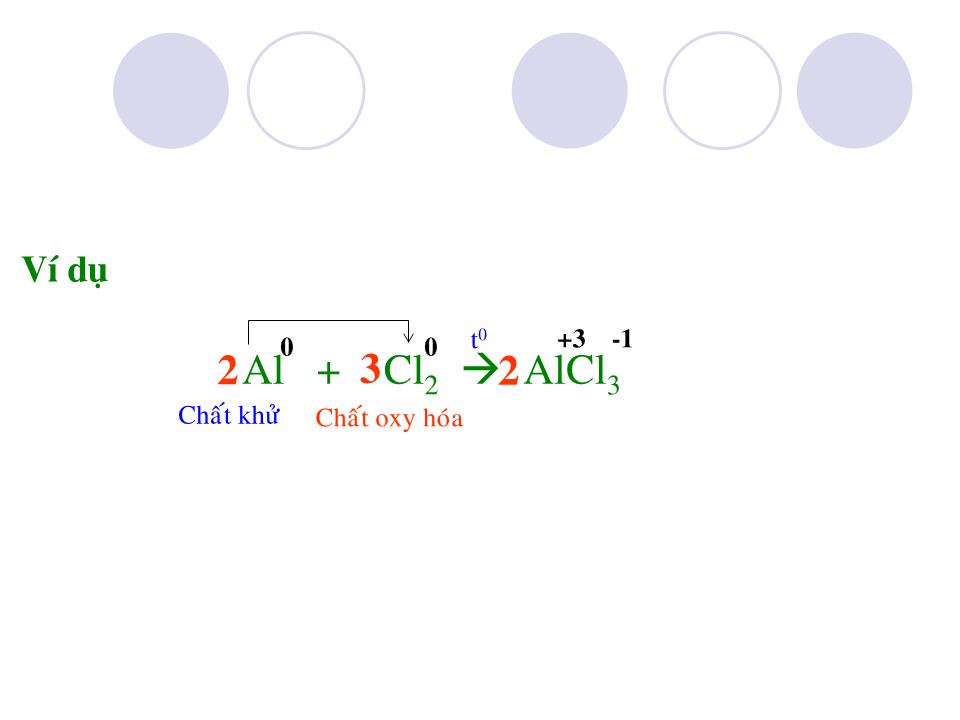
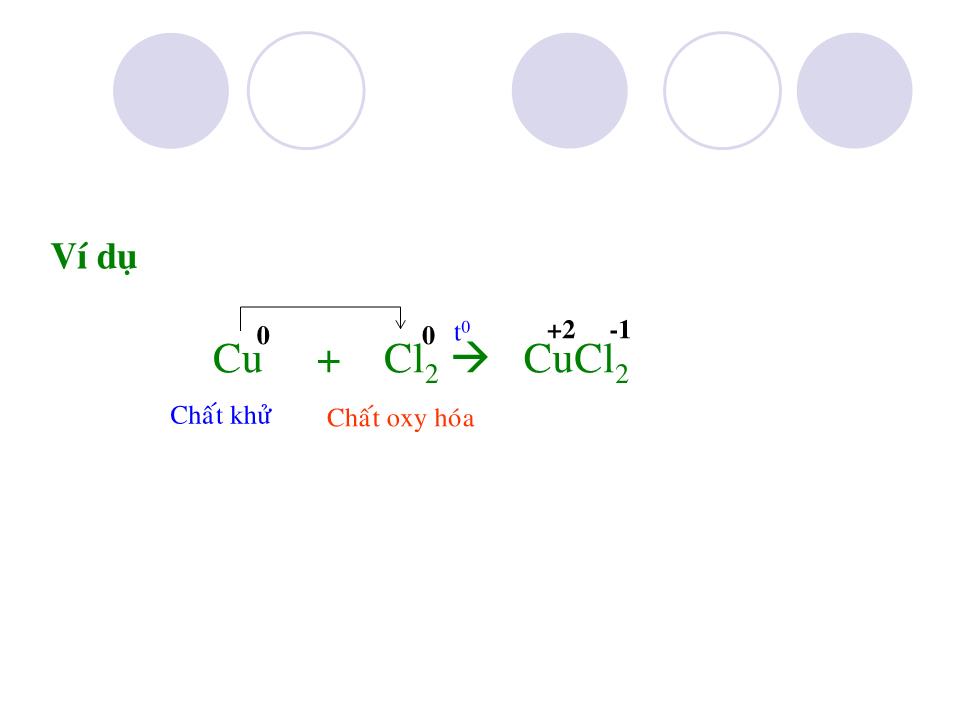
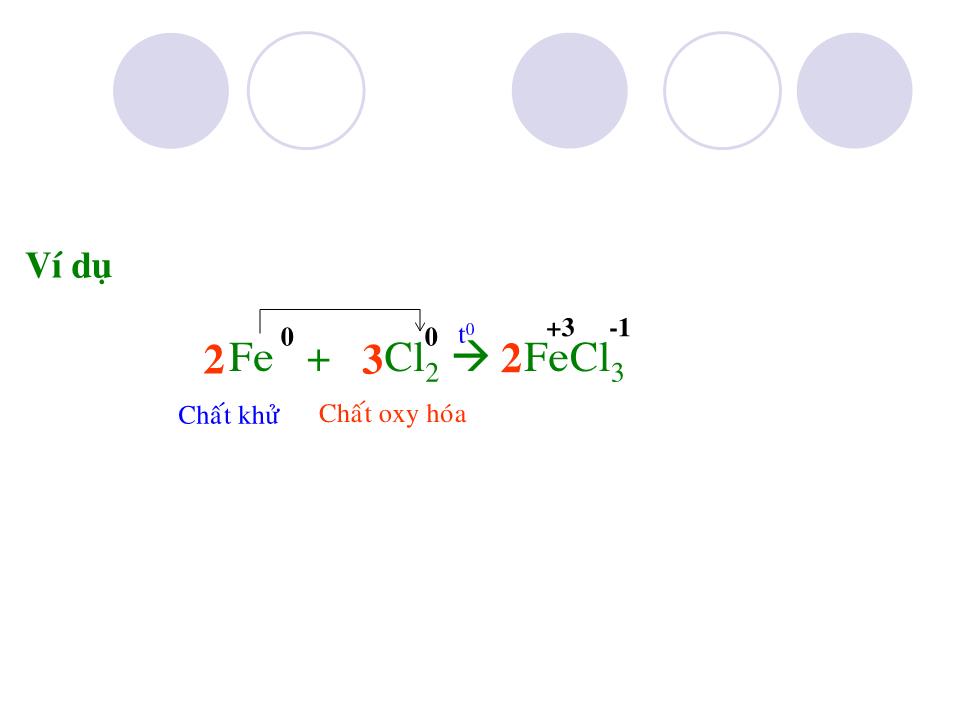
Chào mừng các Thầy Cô Clo Ký hiệu hóa học : Khối lượng nguyên tử : C l 35,5 Có 2 đồng vị : Số thứ tự : Chu kỳ : 17 3 Cấu hình e : 1s 2 2s 2 2p 6 3s 2 3p 5 CTPT : Cl 2 Dạng đơn chất : Dạng hợp chất : - NaCl có trong nước biển , mỏ . - KCl có trong quặng : cacnalit KCl.MgCl 2 .6H 2 O xinvinit KCl.NaCl - Clo chiếm 0,05% khối lượng vỏ trái đất . - Ngoài ra Clo còn có trong huyết thanh động vật , trong dạ dày ( dạng HCl ) I.Trạng thái tự nhiên không ( vì Clo hoạt động hóa học mạnh ) muối clorua Trạng thái : Màu : Mùi : Độc : kích thích mạnh đường hô hấp và làm viêm các niêm mạc d Cl 2 /kk = 71/29 nặng gấp 2,5 lần không khí Ít tan trong nước , ở 20 0 C 1 thể tích H 2 O hòa tan 2,3 thể tích Cl 2 , Clo tan nhiều trong dung môi hữu cơ : benzen (C 6 H 6 ), cacbontetraclorua (CCl 4 ) II.Tính chất vật lý khí vàng lục xốc Do lớp ngoài cùng có 7e nên Clo dễ nhận 1e thể hiện tính oxi hóa trong phản ứng với kim loại và hidro . III.Tính chất hóa học 1-Tác dụng với kim loại : Al + Cl 2 AlCl 3 Ví dụ -1 +3 t 0 Chất khử Chất oxy hóa 2 3 2 0 0 Cu + Cl 2 CuCl 2 -1 +2 t 0 Ví dụ Chất khử Chất oxy hóa 0 0 -1 +3 t 0 Fe + Cl 2 FeCl 3 Ví dụ Chất khử Chất oxy hóa 2 3 2 0 0 Vậy trong phản ứng với kim loại Clo có tính oxi hóa và kim loại đạt mức oxi hóa cao nhất . phản ứng xảy ra nhanh , tỏa nhiều nhiệt tạo muối clorua n Cl 2 + 2M 2MCl n tạo khí hydroclorua : H + Cl 2H Cl - khi tan trong nước 1 phần clo tác dụng với nước : Cl + H 2 O HCl + HCl O ( axít hypoclorơ ) - Và HClO ( axít hypoclorơ ) không bền , tự phân hủy : HCl O HCl + O Do đó axít hypoclorơ có tính oxy hóa mạnh , tính chất này dùng để tẩy trắng vải sợi 3-Tác dụng với nước : Chất khử Chất oxy hóa Chất khử Chất oxy hóa P + Cl 2 PCl 3 Ngoài ra clo còn tác dụng được với phi kim(S , P), dung dịch kiềm(NaOH,KOH , Ca(OH) 2 ), với các hợp chất mà nguyên tố còn có mức oxy hóa cao hơn 2 3 2 2 Cl 2 + NaOH NaCl + Na ClO + H 2 O nước gia ven 2 Fe Cl 2 + Cl 2 Fe Cl 3 2 IV.Điều chế 1-Trong phòng thí nghiệm : từ axít clohydric đậm đặc và chất oxy hóa (MnO 2 , KMnO 4 , . . .) HCl + MnO 2 MnCl 2 + Cl 2 + H 2 O HCl + KMnO 4 KCl + MnCl 2 + Cl 2 + H 2 O 2 4 16 5 8 2 2 2 Cl 2 Sơ đồ điều chế Clo trong phòng thí nghiệm 2-Trong công nghiệp : từ sự điện phân dung dịch đậm đặc muối ăn trong nước , có vách ngăn : NaCl + H 2 O Cl 2 + H 2 + NaOH 2 2 2 V.Ứng dụng Nuớc Clo dùng tiệt trùng trong nhà máy nước , dùng tẩy trắng vải , giấy , điều chế clorua vôi , axít clohydric , dược phẩm , chất màu , chất dẻo , tơ , cao su nhân tạo . . . VI.Củng cố 1-Nêu tính chất hóa học đặc trưng của Clo , giải thích bằng cấu tạo nguyên tử . Clo thể hiện tính oxy hóa mạnh do có 7e lớp ngoài cùng nên dễ nhận thêm 1e hoặc góp chung 1e để đạt cơ cấu bền . 2- Viết phương trình phản ứng xảy ra khi cho Clo tác dụng với Mg, KOH, Ca(OH) 2 , NaBr , KI Cl 2 + Mg MgCl 2 Cl 2 + 2KOH KCl + KClO + H 2 O 2Cl 2 + 2Ca(OH) 2 CaCl 2 + Ca(ClO) 2 + 2H 2 O hay Cl 2 + Ca(OH) 2 CaOCl 2 + H 2 O Clorua vôi Cl 2 + 2NaBr 2NaCl + Br 2 Cl 2 + 2KI 2KCl + I 2 *Halogen có tính oxy hóa mạnh đẩy được halogen yếu hơn ra khỏi dung dịch muối
File đính kèm:
 bai_giang_hao_hoc_lop_9_bai_26_clo.ppt
bai_giang_hao_hoc_lop_9_bai_26_clo.ppt

