Bài giảng Hóa học Lớp 12 - Bài: Kim loại kiềm thổ và hợp chất quan trọng của kim loại kiềm thổ
1/ Vị trí:
- Gồm các nguyên tố: Be;Mg;Ca;Sr;Ba;Ra*đứng liền sau các kim loại kiềm.
2/ Cấu tạo:
-Cấu hình e ở lớp ngoài cùng của IIA: ns2 (các nguyên tố s),có 2 electron hóa trị.

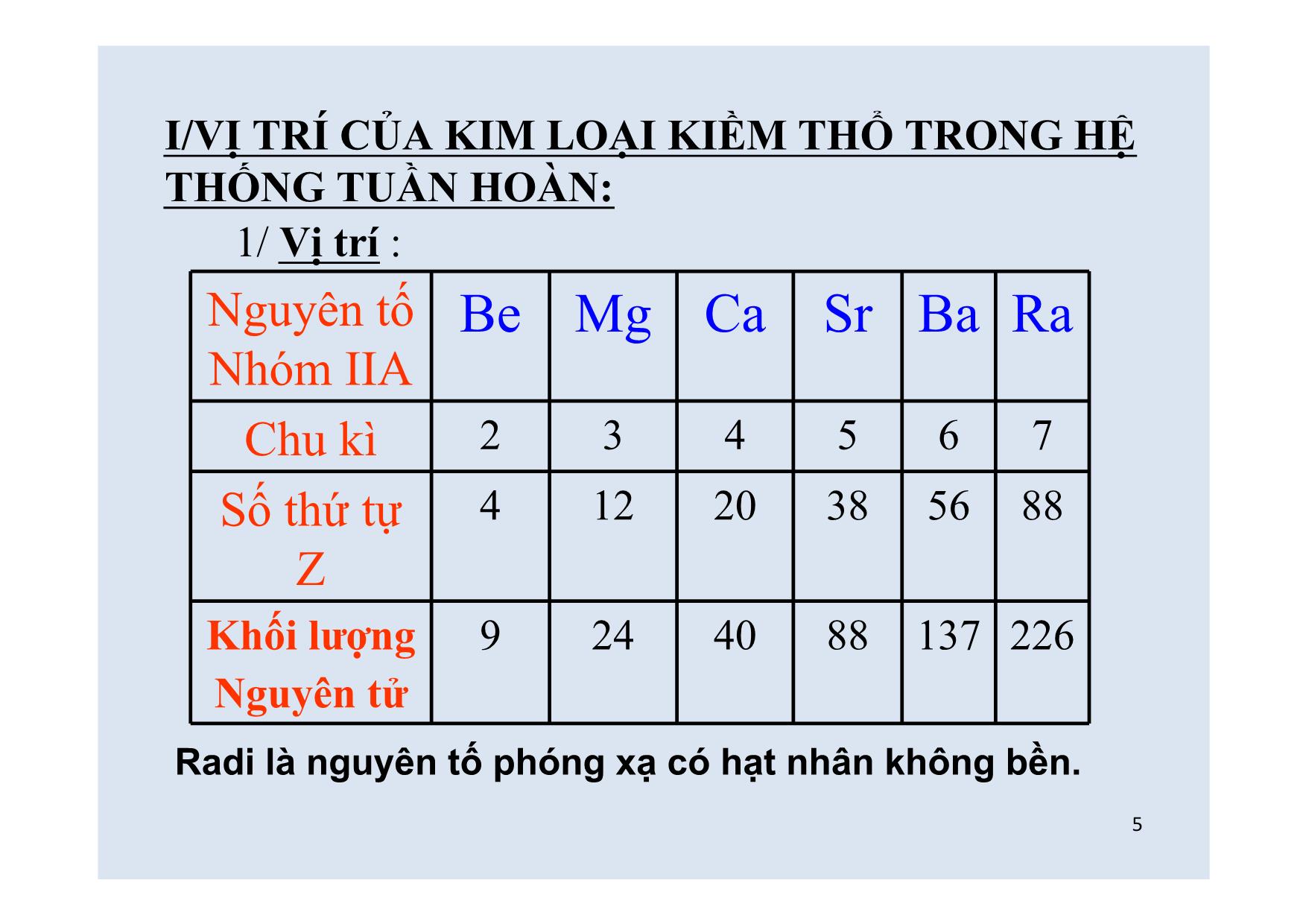
Trang 1

Trang 2

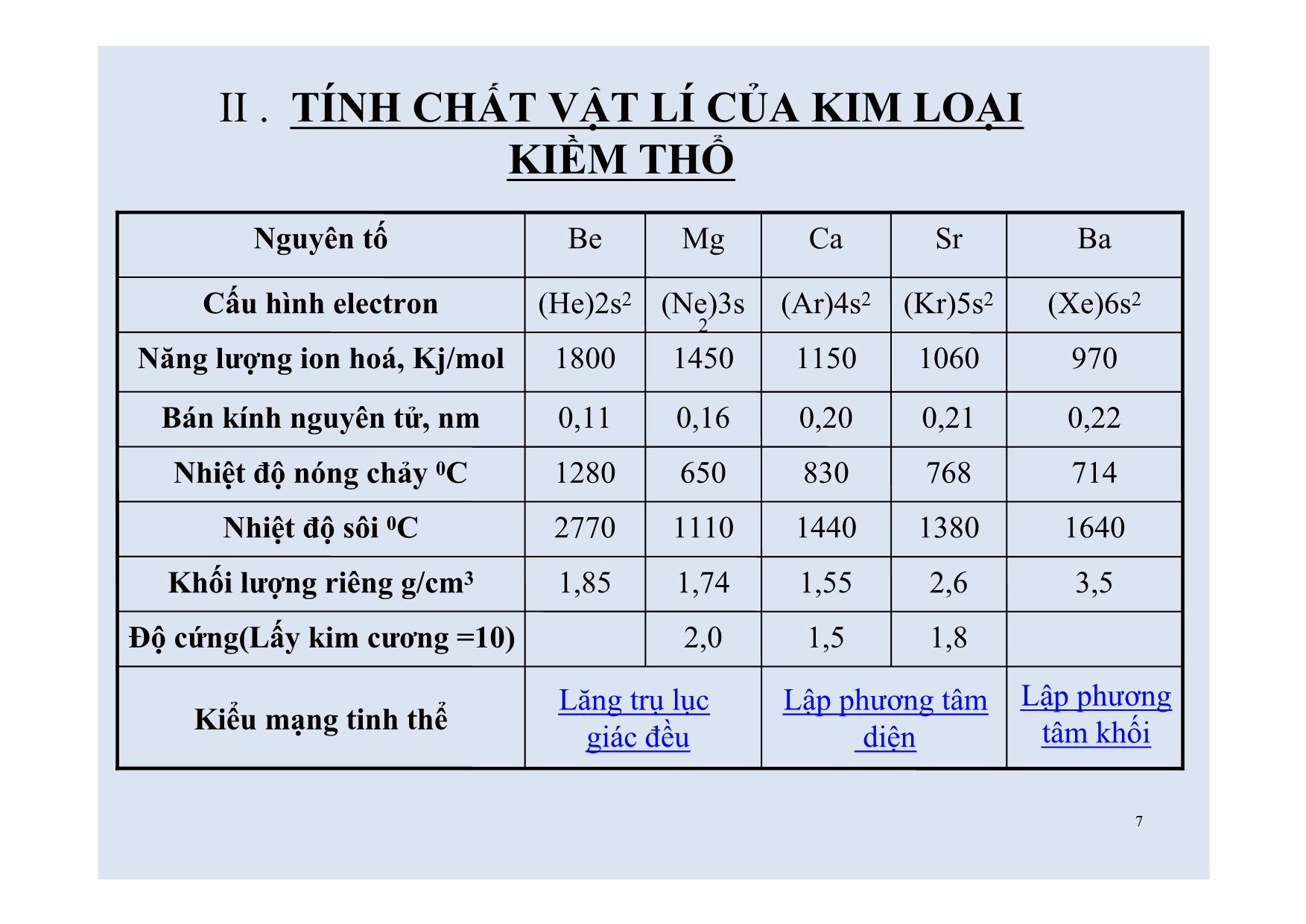
Trang 3

Trang 4
Trang 5

Trang 6
Trang 7

Trang 8

Trang 9

Trang 10
Tải về để xem bản đầy đủ
Bạn đang xem 10 trang mẫu của tài liệu "Bài giảng Hóa học Lớp 12 - Bài: Kim loại kiềm thổ và hợp chất quan trọng của kim loại kiềm thổ", để tải tài liệu gốc về máy hãy click vào nút Download ở trên
Tóm tắt nội dung tài liệu: Bài giảng Hóa học Lớp 12 - Bài: Kim loại kiềm thổ và hợp chất quan trọng của kim loại kiềm thổ

HÓA HỌC LỚP 12 KIM LOẠI KIỀM THỔ VÀ HỢP CHẤT QUAN TRỌNG CỦA KIM LOẠI KIỀM THỔ 2KIỂM TRA BÀI CŨ: Câu 1/ Điều chế Na kim loại, người ta thường dùng phương pháp nào sau đây? A.Điện phân dung dịch NaCl B.Dùng K tác dụng với dung dịch NaCl C.Điện phân NaCl nóng chảy D.Khử Na2O bằng khí CO ở nhiệt độ cao Câu 2/ Hợp chất nào của Na sau đây có thể tác dụng với :HNO3; KOH? A.Na2CO3 B.NaCl C.NaOH D.NaHCO3 3Núi đá vôi Thạch nhũ 4Viết cấu hình e của Mg(Z=12) và Ca(Z=20) từ đó tìm vị trí của chúng trong bảng HTTH? Mg(Z=12) : 1s2 2s2 2p6 3s2 Vị trí: Ô thứ 12 Chu kì 3 Nhóm IIA Ca(Z=40): 1s2 2s2 2p6 3s2 3p6 4s2 Vị trí: Ô thứ 20 Chu kì 4 Nhóm IIA Cả Mg và Ca đều là nguyên tố s 5I/VỊ TRÍ CỦA KIM LOẠI KIỀM THỔ TRONG HỆ THỐNG TUẦN HOÀN: Nguyên tố Nhóm IIA Be Mg Ca Sr Ba Ra Chu kì 2 3 4 5 6 7 Số thứ tự Z 4 12 20 38 56 88 Khối lượng Nguyên tử 9 24 40 88 137 226 Radi là nguyên tố phóng xạ có hạt nhân không bền. 1/ Vị trí : 6-Gồm các nguyên tố:Be;Mg;Ca;Sr;Ba;Ra*đứng liền sau các kim loại kiềm. -Cấu hình e ở lớp ngoài cùng của IIA: ns2 (các nguyên tố s),có 2 electron hóa trị. 2/ Cấu tạo: 1/ Vị trí: 7Kiểu mạng tinh thể 1,81,52,0Độ cứng(Lấy kim cương =10) 3,52,61,551,741,85Khối lượng riêng g/cm3 16401380144011102770Nhiệt độ sôi 0C 7147688306501280Nhiệt độ nóng chảy 0C 0,220,210,200,160,11Bán kính nguyên tử, nm 9701060115014501800Năng lượng ion hoá, Kj/mol (Xe)6s2(Kr)5s2(Ar)4s2(Ne)3s 2 (He)2s2Cấu hình electron BaSrCaMgBeNguyên tố Lập phương tâm diện Lập phương tâm khối Lăng trụ lục giác đều II . TÍNH CHẤT VẬT LÍ CỦA KIM LOẠI KIỀM THỔ 8Mg QUAN SÁT THÊM 1 SỐ MẪU VẬT THỰC TẾ 9II/ TÍNH CHẤT VẬT LÝ CỦA KIM LOẠI KIỀM THỔ -Nhiệt độ nóng chảy và nhiệt độ sôi tương đối thấp (trừ Be). -Độ cứng:kim loại IA < kim loại IIA < Al -Khối lượng riêng nhỏ, nhẹ hơn Al (trừ Ba). Nguyên nhân: -bán kính tương đối lớn -điện tích nhỏ. -lực liên kết kim loại yếu 10 Từ vị trí và đặc điểm cấu tạo hãy suy ra tính chất hóa học của kim loại kiềm thổ? 11 III/ TÍNH CHẤT HÓA HỌC: Các kim loại kiềm thổ có tính khử mạnh. Chất khử 1/ Tác dụng với phi kim: (Nhưng kém kim loại kiềm) Tác dụng với nhiều phi kim như O2;Halogen;S a/ Tác dụng với O2: Ở nhiệt độ thường Be;Mg bị oxh chậm tạo oxít bảo vệ kim loại;ở to cao các kim loại đều cháy tạo oxít kim loại. M = M2+ + 2e Pt TQ: 2M + O2 2MO 0 +2 12 b/ Tác dụng với X2(Hal);S ở trạng thái nóng chảy; Ví dụ: 1/ Ca + Cl2 CaCl2 0 +2 2/ Mg + S MgS0 +2 canxiclorua magiêsunfua to to 2/ Tác dụng với axít: a/ HCl ; H2SO4 loãng: giải phóng khí H2 Ví dụ: Mg + HCl MgCl2 + H20 +2 b/ HNO3 ; H2SO4 đặc: có tính oxh mạnh. Có thể đưa N+5 ;S+6 về mức oxh rất thấp. Ví dụ: Mg + HNO3 (l) ? + N2 + ? 2 13 3/ Tác dụng với nước: Ở nhiệt độ thường Be không phản ứng, Mg phản ứng chậm; các kim loại còn lại(Ca;Sr;Ba)phản ứng mãnh liệt. Pt tổng quát: M + 2H2O M(OH)2 + H2 Ví dụ: Ba + 2H2O Ba(OH)2 + H2 Dd thu được có tính bazơ mạnh. 0 2+ Mg(NO3)2 H2OVí dụ: Mg+ HNO3 (l) + N2 + 0 2++5 05 12 5 6 14 Câu 1/ Dãy nào sau đây sắp xếp theo chiều tăng dần tính khử của kim loại kiềm thổ? A.Be<Ca<Mg<Ba B.Ba<Ca<Mg<Be C.Be<Mg<Ca<Ba D.Mg<Ba<Ca<Be Câu 2/ Cho kim loại Ba vào dung dịch Na2SO4 .Hỏi có hiện tượng hóa học xảy ra trong thí nghiệm trên? A.Kết tủa trắng B.Có khí thoát ra C.Sinh ra Na có ánh kim D.Có khí thoát ra và có kết tủa trắng Phiếu học tập Thank you
File đính kèm:
 bai_giang_hoa_hoc_lop_12_bai_kim_loai_kiem_tho_va_hop_chat_q.pdf
bai_giang_hoa_hoc_lop_12_bai_kim_loai_kiem_tho_va_hop_chat_q.pdf

