Bài giảng Hóa học Lớp 11 - Bài: Anken
Mục tiêu
- Nắm vững công thức, tên gọi của các anken.
- Viết phản ứng cộng, phản ứng trùng hợp, phản ứng oxi hoá hoàn toàn.
- Biết phương pháp điều chế CH2=CH2

Trang 1

Trang 2

Trang 3

Trang 4

Trang 5

Trang 6
Trang 7
Trang 8
Trang 9

Trang 10
Tải về để xem bản đầy đủ
Bạn đang xem 10 trang mẫu của tài liệu "Bài giảng Hóa học Lớp 11 - Bài: Anken", để tải tài liệu gốc về máy hãy click vào nút Download ở trên
Tóm tắt nội dung tài liệu: Bài giảng Hóa học Lớp 11 - Bài: Anken

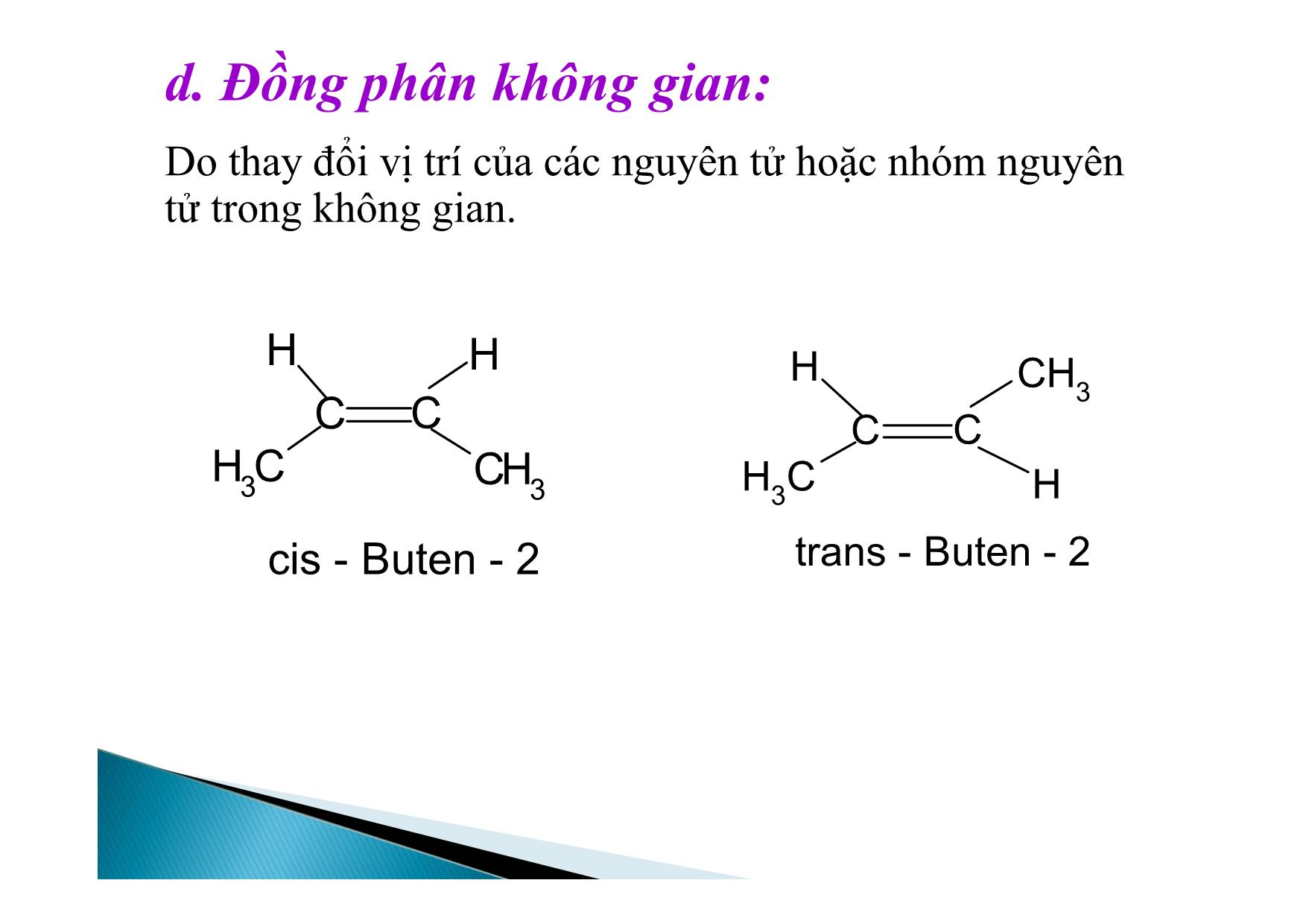
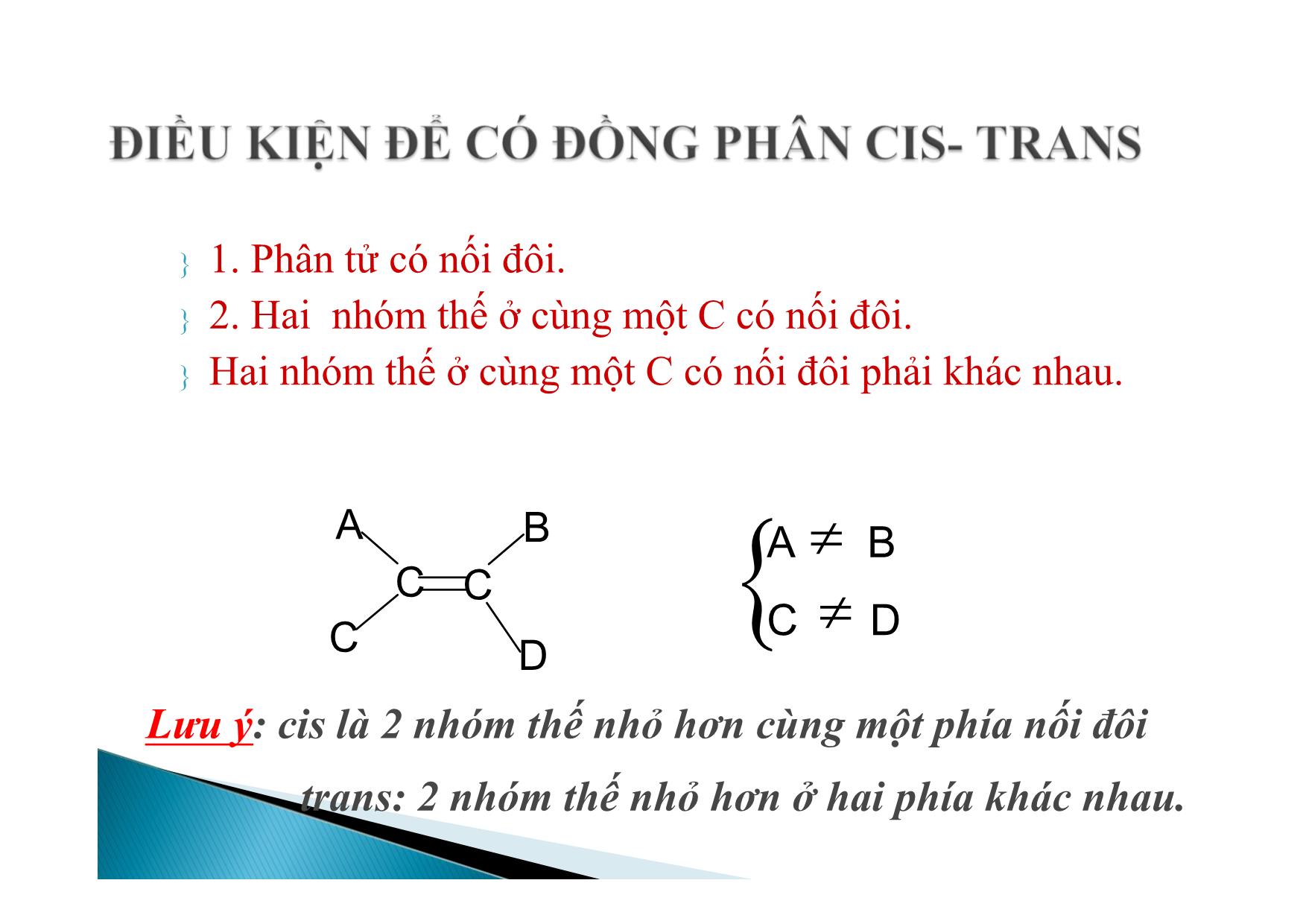
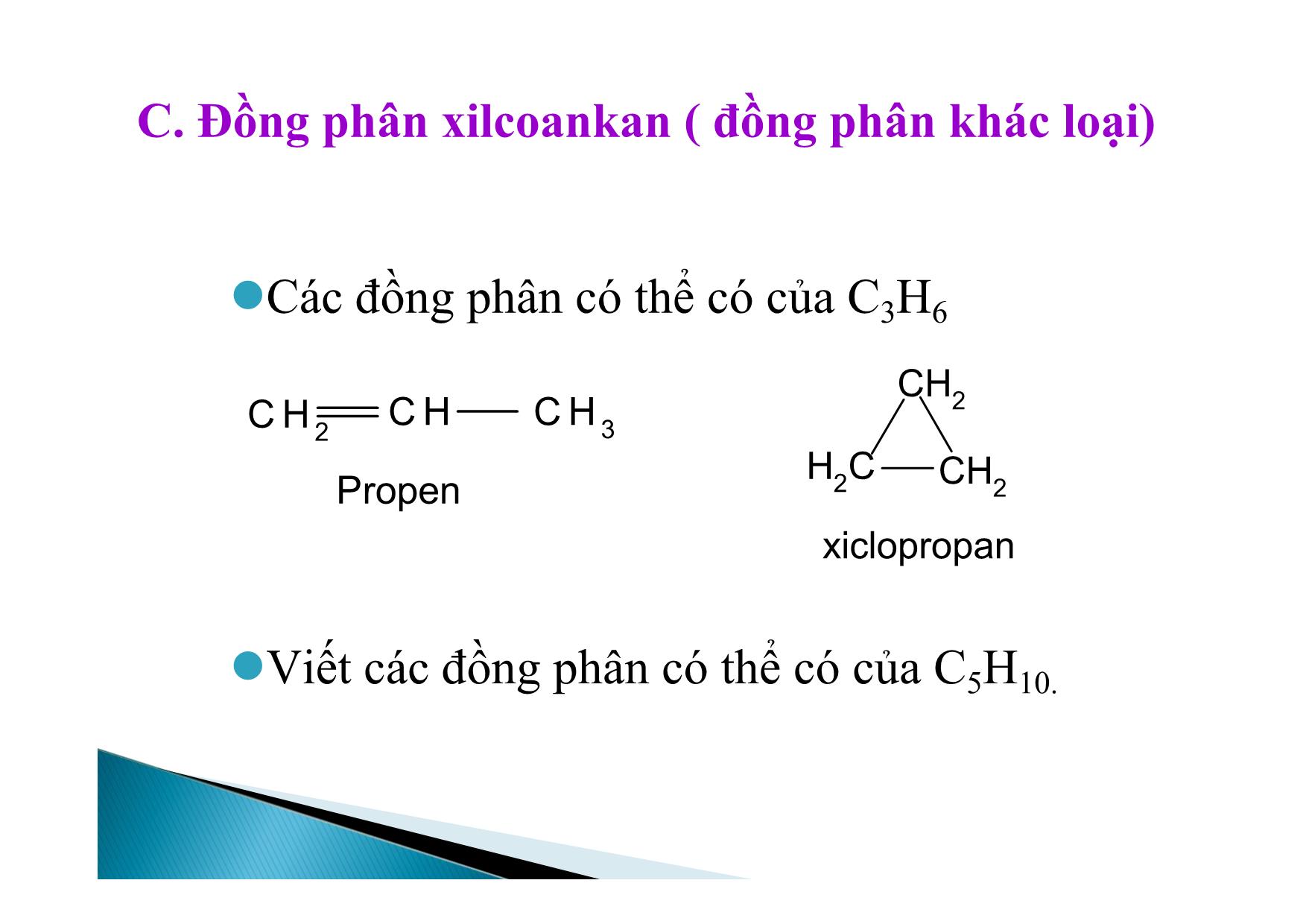
BÀI GIẢNG HÓA HỌC 11 ANKEN Nắm vững công thức, tên gọi của các anken. Viết phản ứng cộng, phản ứng trùng hợp, phản ứng oxi hoá hoàn toàn. Biết phương pháp điều chế CH2=CH2 I. Đồng đẳng, đồng phân, danh pháp II. Cấu tạo anken III. Tính chất vật lý IV. Tính chất hóa học 1. Đồng đẳng C2H4, C3H6, C4H8,CnH2n tạo thành dãy đồng đẳng của etilen ( gọi là dãy đồng đẳng của etilen hay olefin). Định nghĩa: Anken là các hidrocacbon mạch hở, có một nối đôi trong phân tử. CTTQ: CnH2n (n 2) Xuất phát từ tên gọi của ankan tương ứng A. danh pháp quốc tế Đổi – an → -en Ví dụ: C2H4 : Etilen hay Eten C3H6 : Propilen hay propen a. Từ C4H8 trở lên có đồng phân b. Đồng phân mạch C. CH3- CH2- CH=CH c. Đồng phân C so vị trí nối đôi: CH3- CH2- CH = CH2 (Buten-1) CH3- CH2= CH- CH3 (Buten-2) Chú ý: Khi gọi tên phải chỉ rõ vị trí nối đôi (đánh số nguyên tử C từ phía gần nối đôi). CH3 C CH2CH3 d. Đồng phân không gian: Do thay đổi vị trí của các nguyên tử hoặc nhóm nguyên tử trong không gian. H CH3 H CH3 CC cis - Buten - 2 CH3 H H CH3 CC trans - Buten - 2 1. Phân tử có nối đôi. 2. Hai nhóm thế ở cùng một C có nối đôi. Hai nhóm thế ở cùng một C có nối đôi phải khác nhau. BA C D CC A B C D Lưu ý: cis là 2 nhóm thế nhỏ hơn cùng một phía nối đôi trans: 2 nhóm thế nhỏ hơn ở hai phía khác nhau. C. Đồng phân xilcoankan ( đồng phân khác loại) Các đồng phân có thể có của C3H6 C HC H 2 C H 3 Propen CH2 CH2 H2C xiclopropan Viết các đồng phân có thể có của C5H10. 1. Cấu tạo anken Nhận xét: Các nguyên tử nằm trong cùng một mặt phẳng. Góc HCH=HCC=CCC=1200 Phân tử các anken có một liên lết đôi ( gồm liên kết xích ma bền vững và một liên két π kém bền). CC H H H HCC H HH H 120O 120 O Liên kết trong phân tử anken Sự tạo tành liên kết trong anken A. Nhận xét chung: trong phân ử có một liên kết π kém bên nên khả năng phản ứng cao. B. Các phản ứng của anken. 1. Các phản ứng cộng: a. cộng tác nhân đối xúng b. cộng tác nhân bất đối xứng 2. . Phản ứng trung hợp 3. . Phản ứng oxi hóa A. Phản ứng cộng tác nhân bất đối xứng Cộng Halogen CH2 = CH2 + Br-Br CH2Br - CH2Br (màu vàng) 1,2-dibrometan ( không màu) Phản ứng này làm mất màu nước brom được dùng để nhận ra liên kết bội Cộng Hidro CH2 = CH2 + H2 CH3 – CH3 otNi, b. Cộng tác nhân bất đối xứng Cộng HA ( HI, HBr, HCl, H-HSO4. CH2 = CH2 + H-Cl CH3-CH2-Cl Với đồng đẳng dễ phản ứng hơn CH CH2CH3 H Cl CH Cl CH3CH3 CH2CH3 CH2Cl + 2-Clopropan 1-Clopropan SPC SPP Nội dung: Trong phản ứng cộng HA nguyên tử H ( hay thành phần mang điện tích dương) cộng vào nguyên tử cacbon có nhiều H hơn, còn nguyên tử A(Cl2Br2OH tức phần mang điện tích âm) sẽ cộng vào nguyên tử C có ít H hơn. Như vậy sản phẩm phản ứng theo quy tắc trên là sản phẩm chính. nCH2 = CH2 (-CH2 - CH2 - )n P.E (polietilen) *Điều kiện để có phản ứng trùng hợp: - Monome có liên kết kép. - Có nhiệt độ, xúc tác, áp suất thích hợp. Chú ý: Cách viết phương trình phản ứng trùng hợp. Các gốc anken có 2 gốc ankyl ở 2 C nối đôi rất khó trùng hợp. xtto, R1 R3 R2 CC R4R1 n CC R4R2 R3 n xt, to a. Cháy trong không khí Phản ứng oxi hóa hoàn toàn: C2H4 + 3O2 2CO2 + 2H2O TQ : CnH2n + 3n/2 O2 nCO2 + nH2O Lưu ý: Khi anken cháy nCO2/nH2O = 1 và ngược lại điều này đúng cho cả hỗn hợp anken. Các anken làm mất màu dung dịch thuốc tím H2C CH2 2KMnO4 4H2O H2C CH2 OH OH 2KOH 2MnO23 3 Phản ứng này dựng để nhận ra liờn kết kộp. Sản xuất axit axetic: 2CH2 = CH2 +O2 2CH3 - CHOPdCl2, CuCl2 Câu 1. Có bao nhiêu đồng phân anken C5H10? A.12 B. 5 C. 9 D. 8 Câu 2. Để nhận biết 2 khí etan và etilen người ta dùng: A. Cl2 (AS) B. Br2 (hơi) C. dd Br2 D. H2
File đính kèm:
 bai_giang_hoa_hoc_lop_11_bai_anken.pdf
bai_giang_hoa_hoc_lop_11_bai_anken.pdf

