Bài giảng Hóa học Lớp 11 - Bài 2: Axit. Bazơ. Muối
AXIT-BAZƠ-MUỐI
- Axit và bazơ theo thuyết
- A-rê-ni-ut.
- Khái niệm về axit-bazơ theo thuyết Bờ-Rôn-Stét.
- Hằng số phân li axit và bazơ.
- Muối.

Trang 1

Trang 2

Trang 3
Trang 4

Trang 5
Trang 6
Trang 7

Trang 8

Trang 9

Trang 10
Tải về để xem bản đầy đủ
Bạn đang xem 10 trang mẫu của tài liệu "Bài giảng Hóa học Lớp 11 - Bài 2: Axit. Bazơ. Muối", để tải tài liệu gốc về máy hãy click vào nút Download ở trên
Tóm tắt nội dung tài liệu: Bài giảng Hóa học Lớp 11 - Bài 2: Axit. Bazơ. Muối

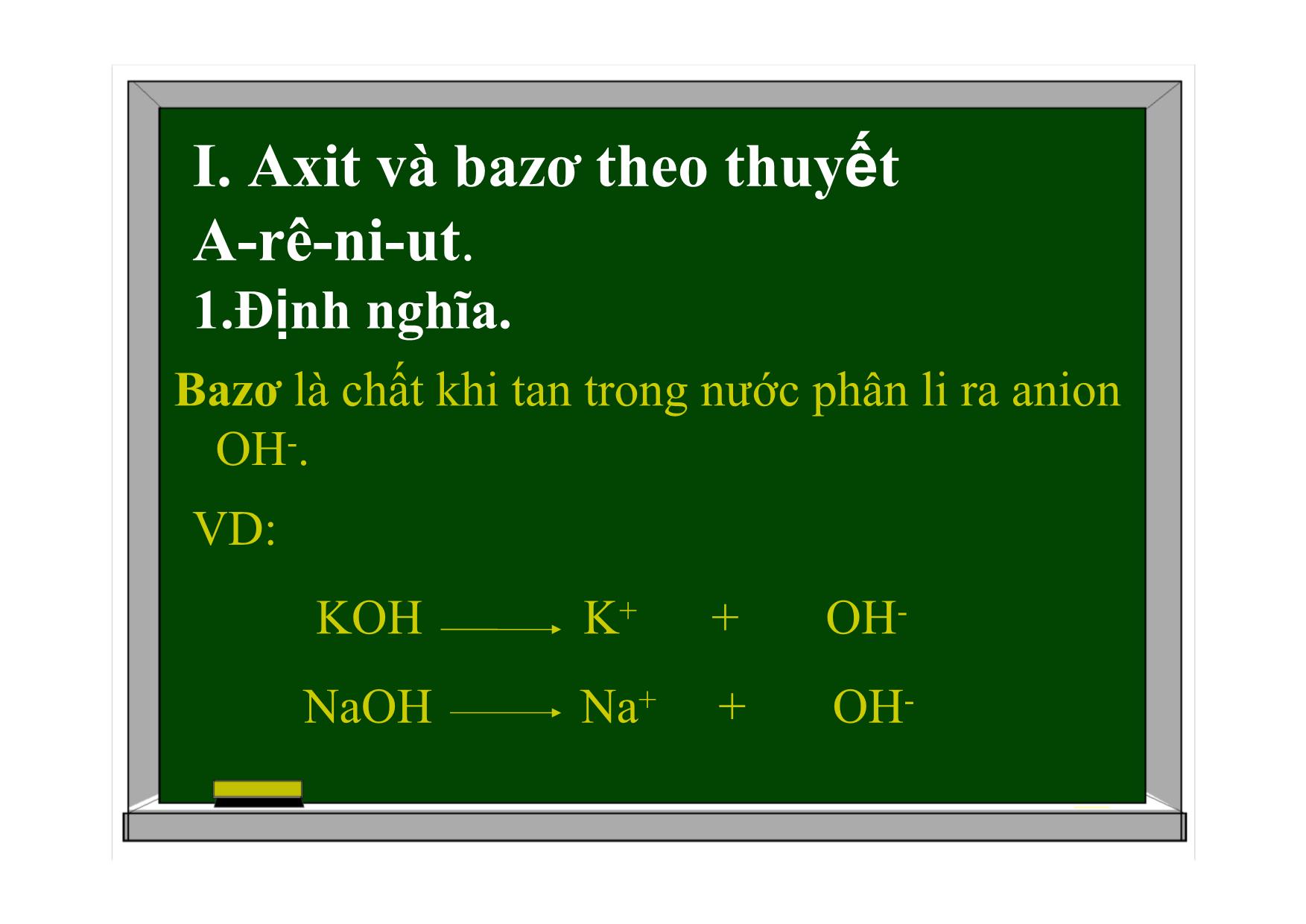
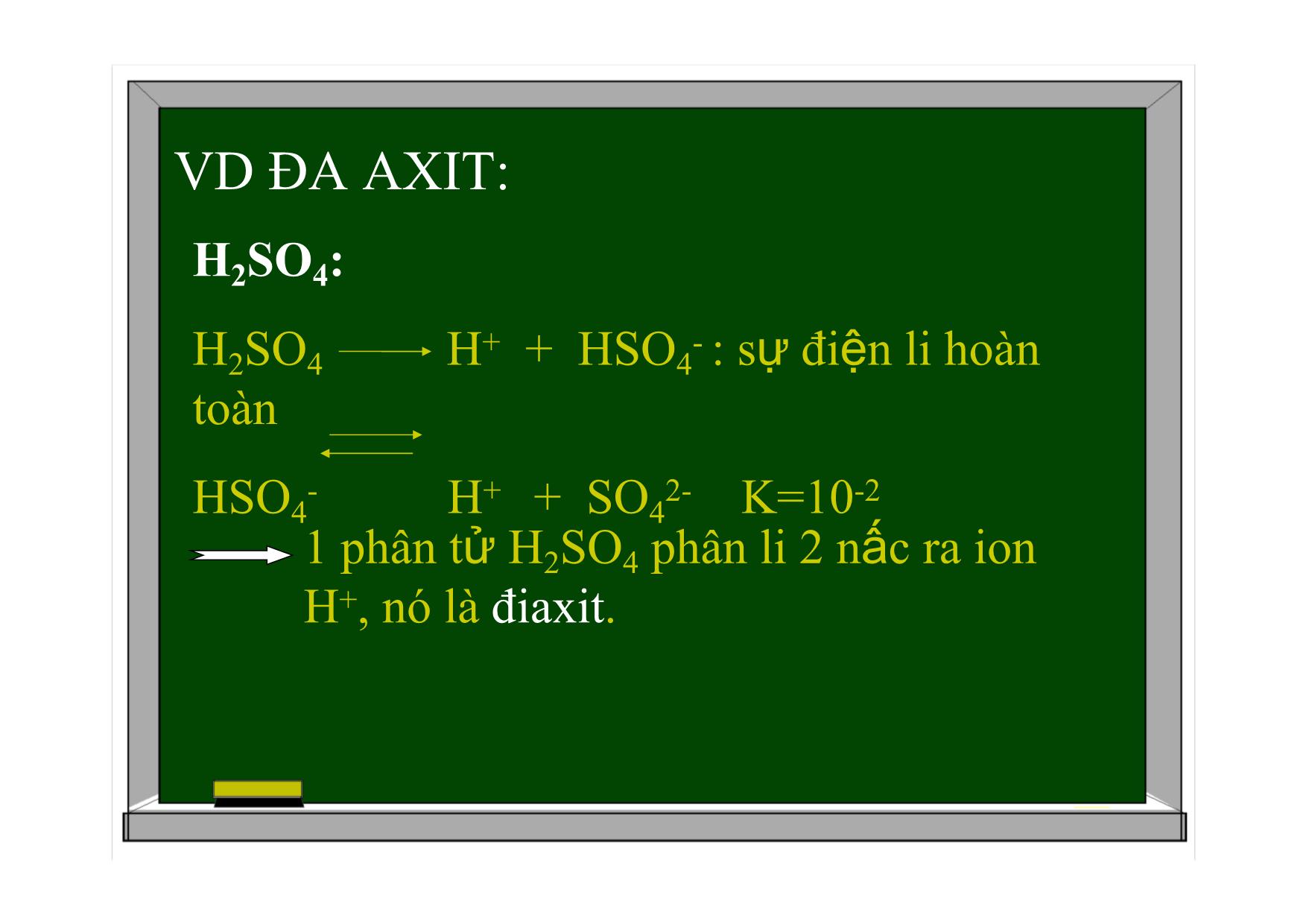
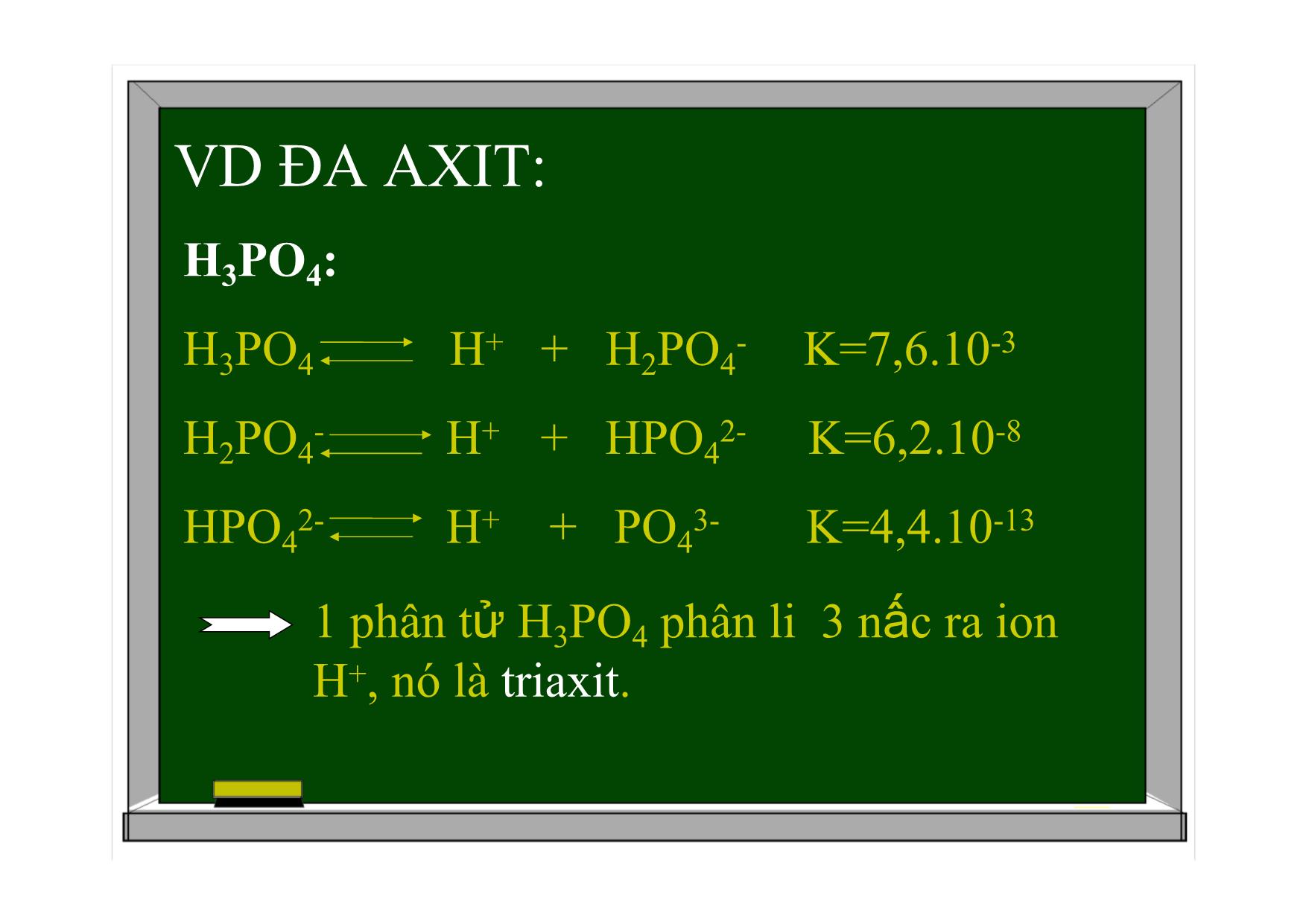
BÀI 2: AXIT-BAZƠ-MUỐI BÀI GIẢNG HÓA HỌC 11 AXIT-BAZƠ-MUỐI Axit và bazơ theo thuyết A-rê-ni-ut. Khái niệm về axit-bazơ theo thuyết Bờ-Rôn-Stét. Hằng số phân li axit và bazơ. Muối. I. Axit và bazơ theo thuyết A-rê-ni-ut. 1.Định nghĩa. Axit là chất khi tan trong nước phân li ra cation H+. HCl H+ + Cl- CH3COOH H+ + CH3COO- AXIT-BAZƠ-MUỐI Bazơ là chất khi tan trong nước phân li ra anion OH-. I. Axit và bazơ theo thuyết A-rê-ni-ut. 1.Định nghĩa. VD: KOH K+ + OH- NaOH Na+ + OH- I. Axit và bazơ theo thuyết A-rê-ni-ut. 2. Đa axit, đa bazơ. a. Đa axit. Đơn axit (monoaxit): là axit mà mỗi phân tử chỉ phân li 1 nấc ra ion H+. VD: HCl, CH3COOH Đa axit (poliaxit): là những axit mà 1 phân tử phân li nhiều nấc ra ion H+ VD ĐA AXIT: H2SO4: H2SO4 H+ + HSO4- : sự điện li hoàn toàn HSO4- H+ + SO42- K=10-21 phân tử H2SO4 phân li 2 nấc ra ion H+, nó là điaxit. VD ĐA AXIT: H3PO4: H3PO4 H+ + H2PO4- K=7,6.10-3 H2PO4- H+ + HPO42- K=6,2.10-8 HPO42- H+ + PO43- K=4,4.10-13 1 phân tử H3PO4 phân li 3 nấc ra ion H+, nó là triaxit. 2. Đa axit, đa bazơ. b. Đa bazơ. Đơn bazơ (monobazơ): là những bazơ mà mỗi phân tử chỉ phân li 1 nấc ra nhóm OH- VD: KOH, NaOH Đa bazơ (polibazơ) : là những bazơ mà mỗi phân tử phân li nhiều nấc ra nhóm OH-. VD: Ca(OH)2 I. Axit và bazơ theo thuyết A-rê-ni-ut. 3. Hiđroxit lưỡng tính. Hiđroxit lưỡng tính là chất khi tan trong nước vừa có thể phân li như axit, vừa có thể phân li như bazơ. VD: Zn(OH)2 Zn(OH)2 2OH- + Zn2+ Phân li kiểu bazơ Zn(OH)2 2H+ + ZnO22- Phân li kiểu axit (H2ZnO2) Zn(OH)2, Al(OH)3, Pb(OH)2, Sn(OH)2, Cr(OH)3 1 số hiđroxit lưỡng tính thường gặp: Đặc điểm: ít tan trong nước. Có tính axit và bazơ yếu. II. Khái niệm về axit và bazơ theo thuyết Bờ-Rôn-Stet. 1. Định nghĩa. Axit là chất nhường proton (H+). Bazơ là chất nhận proton. Axit Bazơ + H+ II. Khái niệm về axit và bazơ theo thuyết Bờ-Rôn-Stet. VD1: CH3COOH + H2O CH3COO- + H3O+ H+ CH3COOH là axit, H2O là bazơ. Trong phản ứng nghịch: CH3COO- là bazơ, H3O+ là axit. VD2: NH3 + H2O NH4+ + OH- NH3 và OH- là bazơ. H2O và NH4+ là axit. H+ VD3: HCO3- + H2O CO32- + H3O+ HCO3- và H3O+ là axit, H2O và CO32- là bazơ H+ HCO3- + H2O H2CO3 + OH- H+ HCO3-, OH- là bazơ, H2O và H2CO3 là axit HCO3- và H2O là chất lưỡng tính II. Khái niệm về axit và bazơ theo thuyết Bờ-Rôn-Stet. Nhận xét: H2O là chất lưỡng tính. Axit và bazơ có thể là phân tử hoặc ion. 2. Ưu điểm của thuyết Bờ-Rôn-Stet. Tổng quát hơn, áp dụng cho bất kì dung môi nào, cả khi vắng mặt dung môi. III. Hằng số phân li axit và bazơ 1. Hằng số phân li axit. CH3COOH CH3COO- + H+ Ka= Giá trị Ka càng nhỏ, lực axit của nó càng yếu. [CH3COO-].[H+] [CH3COOH] Ka=f(T) 2. Hằng số phân li bazơ. NH3 + HOH NH4+ + OH- Kb= [NH4+].[OH-] [NH3] Kb=f(T) Giá trị Kb của bazơ càng nhỏ, lực bazơ của nó càng yếu. IV. Muối 1. Định nghĩa. Muối là hợp chất khi tan trong nước phân li ra cation kim loại (hoặc cation NH4+) và anion gốc axit. VD: NaHCO3 Na+ + HCO3- (NH4)2SO4 2NH4+ + SO42- IV. Muối 1. Định nghĩa. Phân loại: Muối trung hoà: trong phân tử không còn hiđro VD: NaCl, Na2CO3, (NH4)2SO4 Muối axit: trong phân tử còn hiđro. VD: NaHCO3, NaH2PO4, NáHO4 Muối kép VD: NaCl.KCl, KCl.MgCl2.6H2O 2. Sự điện li của muối trong nước. Muối cation kim loại + anion gốc axit (NH4+) VD: K2SO4 2K+ + SO42- NaHCO3 Na+ + HCO3- HCO3- H+ + CO32- 2. Sự điện li của muối trong nước. VD: [Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl- [Ag(NH3)2]+ Ag+ + 2NH3
File đính kèm:
 bai_giang_hoa_hoc_lop_11_bai_2_axit_bazo_muoi.pdf
bai_giang_hoa_hoc_lop_11_bai_2_axit_bazo_muoi.pdf

