Ảnh hưởng của tá dược kiểm soát giải phóng và tá dược siêu rã đến độ hòa tan của viên nén hai lớp Diltiazem Hydroclorid
Mục tiêu: khảo sát, lựa chọn loại, tỷ lệ tá dược kiểm soát giải phóng, tá dược siêu rã để xây
dựng công thức bào chế viên hai lớp diltiazem hydroclorid (DIL) giải phóng nhanh (GPN) và giải
phóng kéo dài (GPKD). Đối tượng: DIL chuẩn hàm lượng 99,9%. Phương pháp: định lượng DIL
bằng phương pháp quang phổ hấp thụ UV; bào chế lớp GPN bằng phương pháp dập thẳng và
lớp GPKD bằng phương pháp xát hạt ướt; khảo sát ảnh hưởng của các tá dược kiểm soát giải
phóng (HPMC K4M, HPMC K100M, gôm xanthan) và tá dược siêu rã (natri croscarmellose,
natri starch glycolat, crosspovidon, L-HPC) đến độ hòa tan của viên nén hai lớp DIL. Kết quả:
đã thẩm định được phương pháp quang phổ hấp thụ UV để định lượng nồng độ DIL trong môi
trường hòa tan có pH 7,5; khảo sát được ảnh hưởng của các tá dược kiểm soát giải phóng và
tá dược siêu rã đến độ hòa tan của DIL ra khỏi viên hai lớp. Kết luận: đối với lớp GPKD, HPMC
K4M (30%) và đối với lớp GPN, crosspovidon (30%) là những tá dược thích hợp để xây dựng
công thức bào chế viên DIL hai lớp GPN và GPKD.

Trang 1

Trang 2
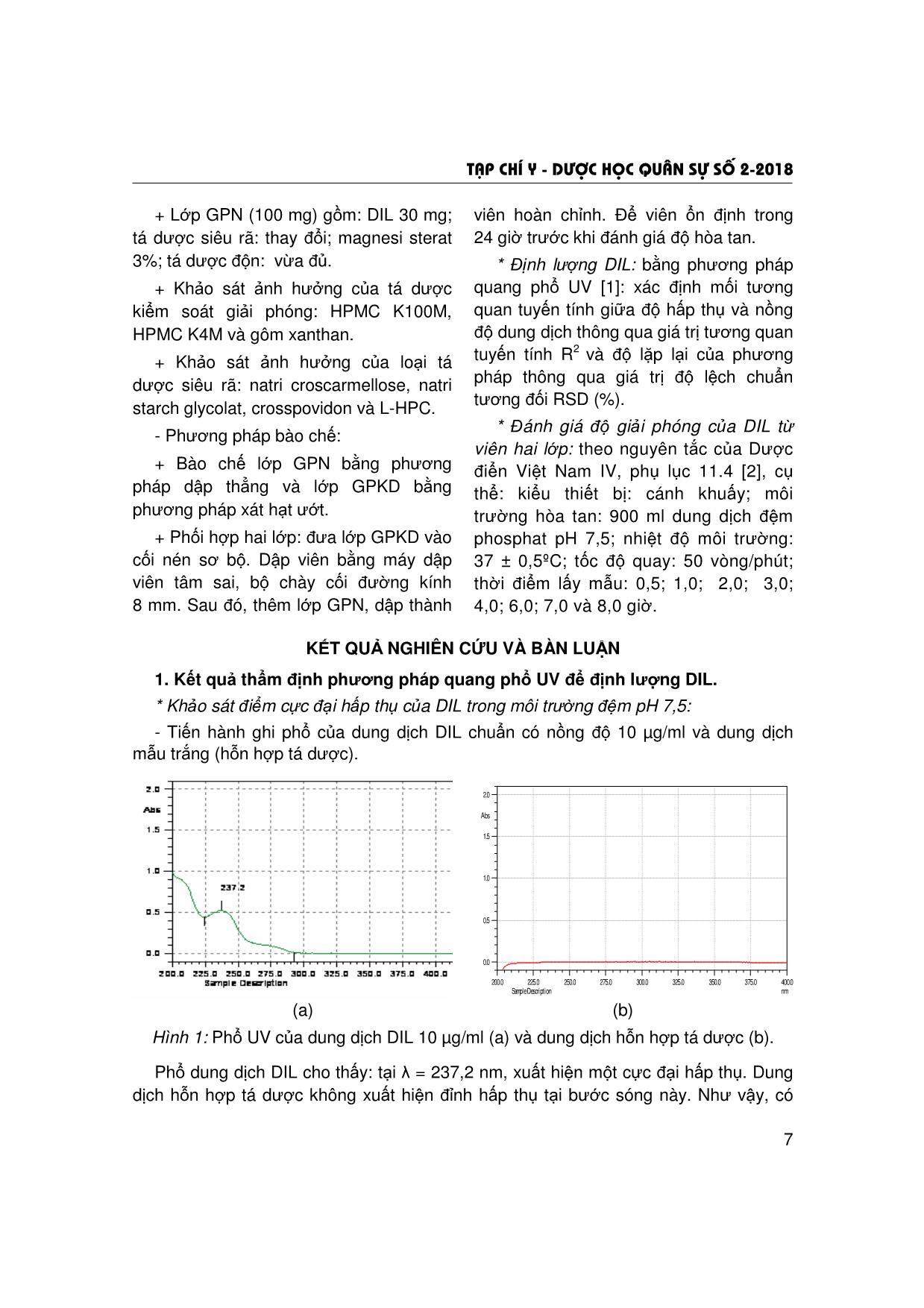
Trang 3
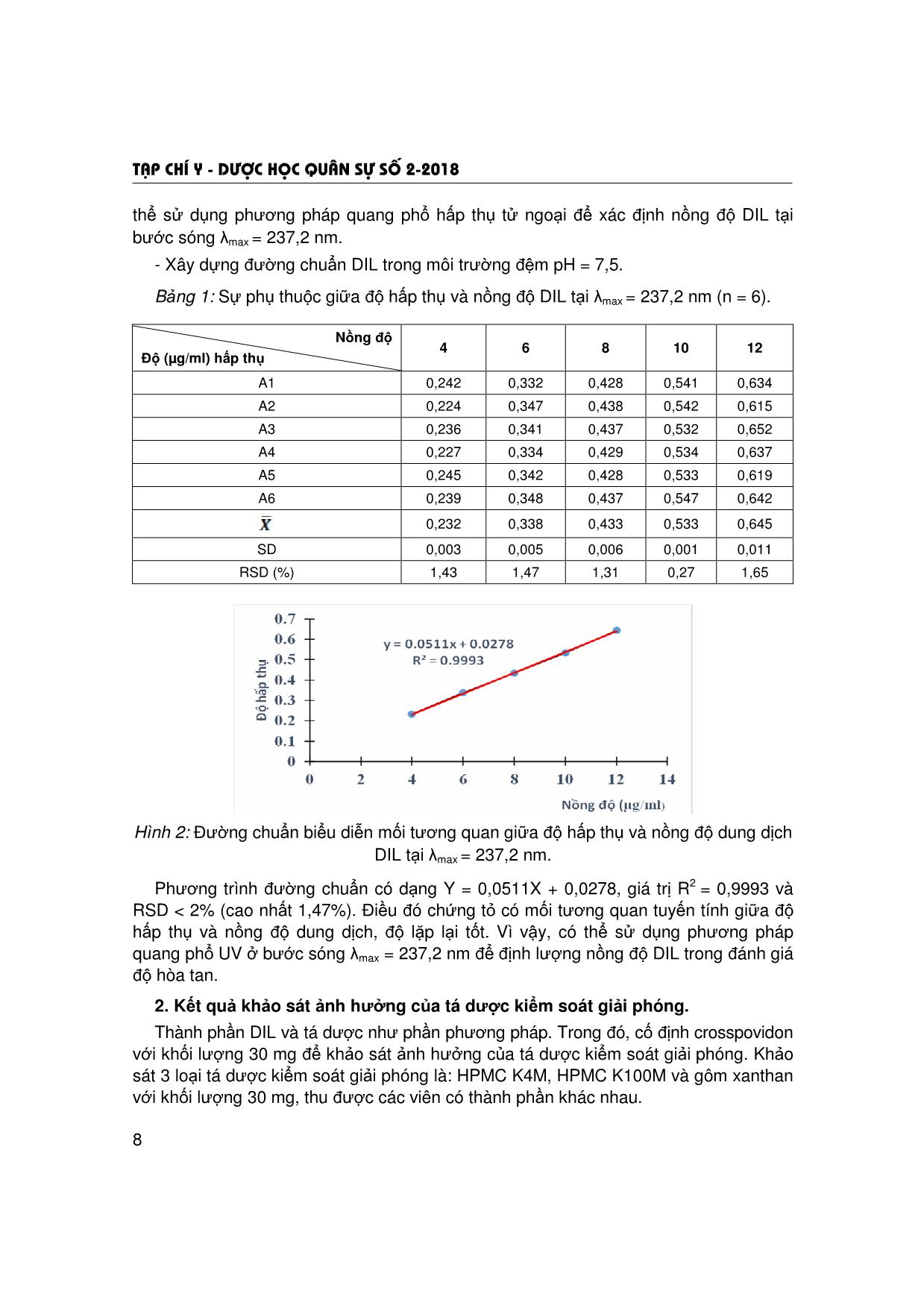
Trang 4
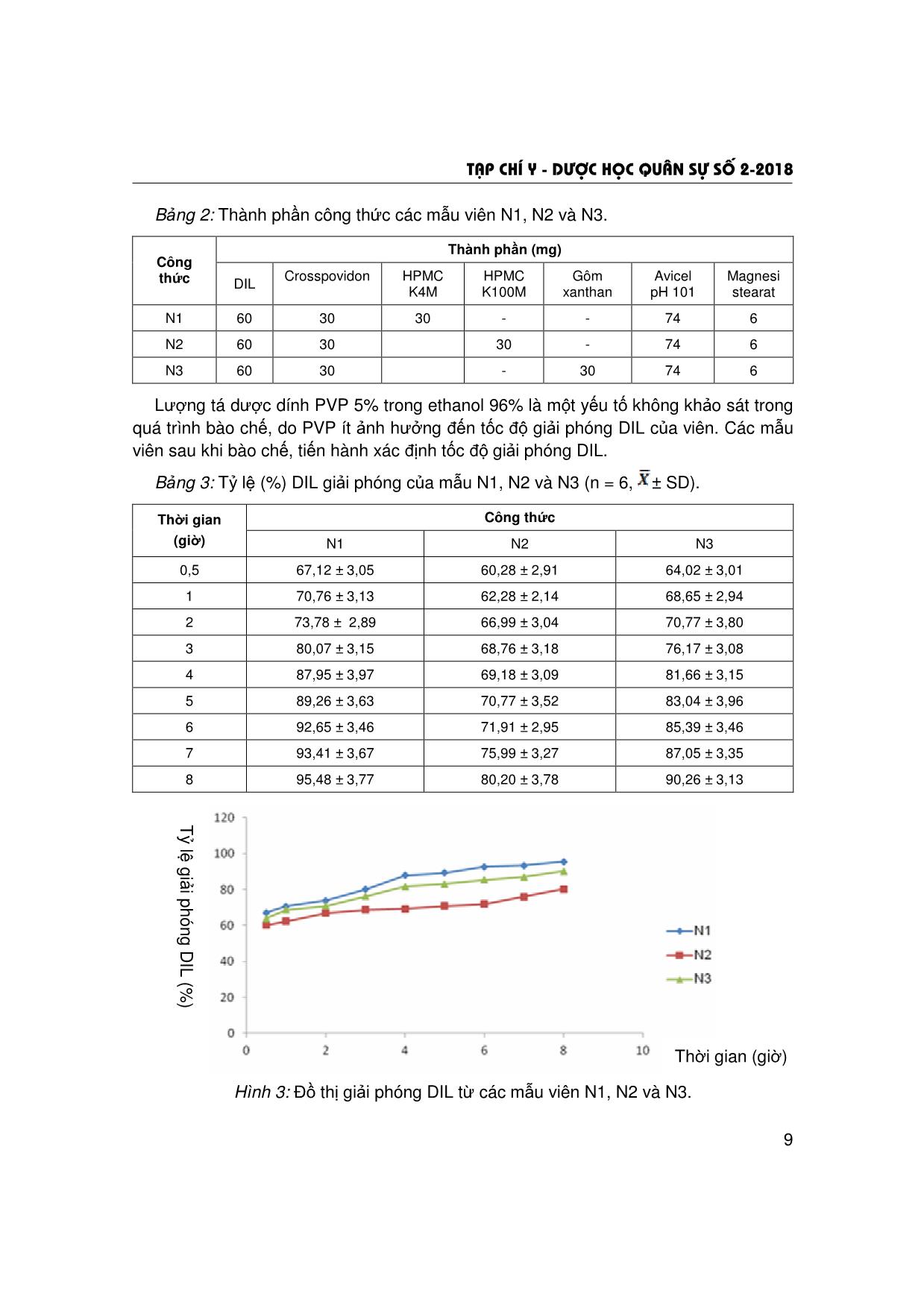
Trang 5
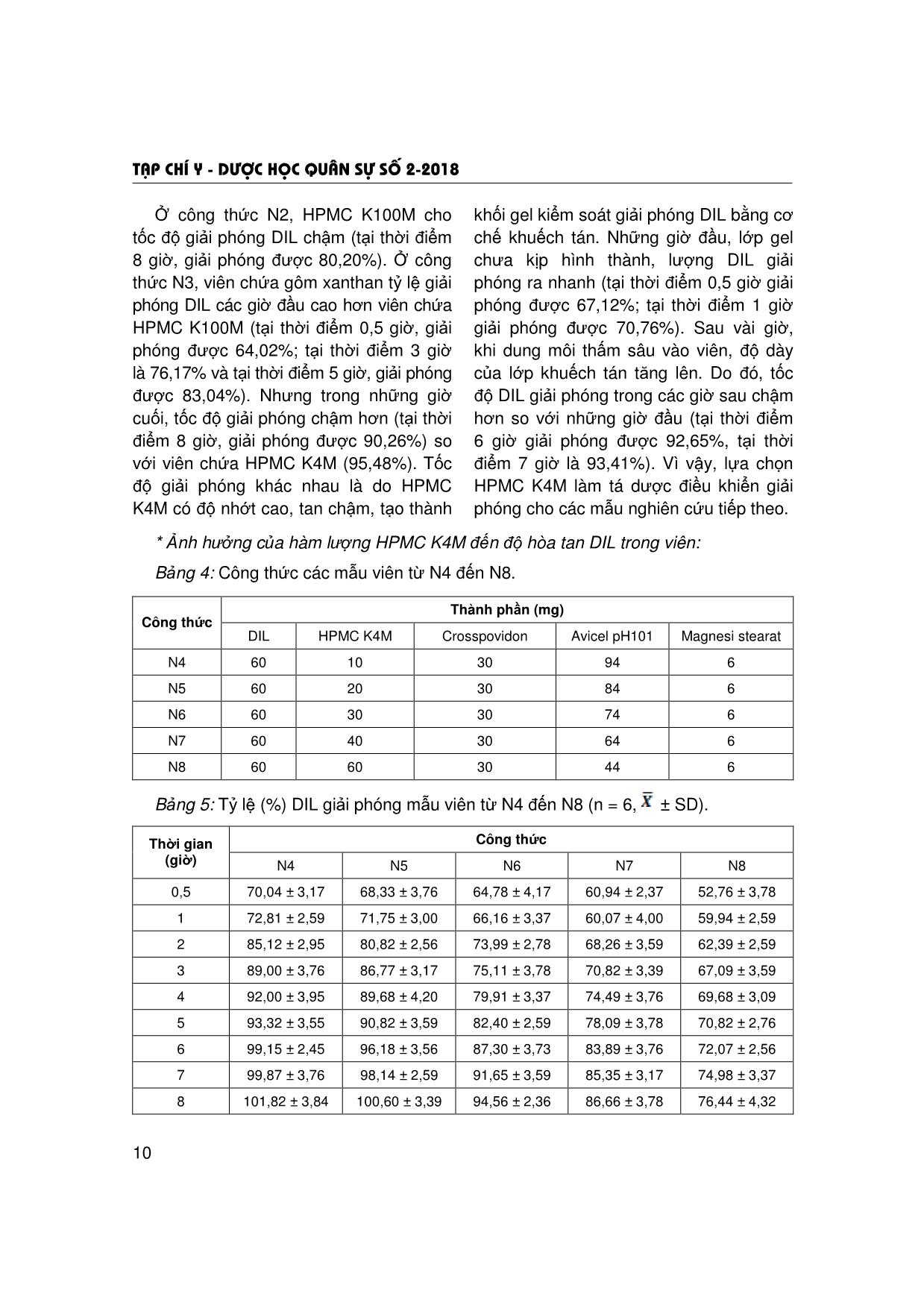
Trang 6
Trang 7
Trang 8
Trang 9

Trang 10
Tóm tắt nội dung tài liệu: Ảnh hưởng của tá dược kiểm soát giải phóng và tá dược siêu rã đến độ hòa tan của viên nén hai lớp Diltiazem Hydroclorid

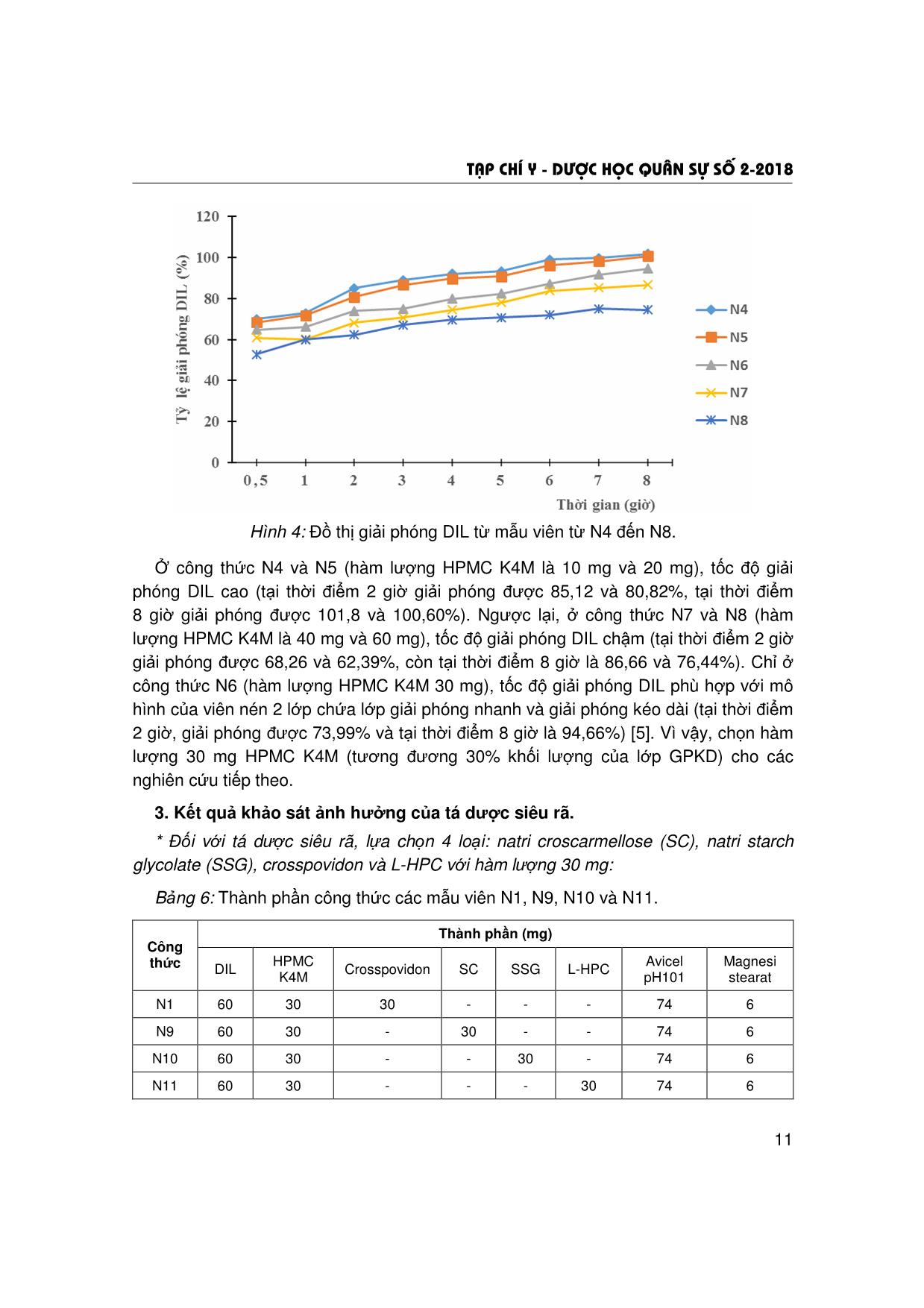
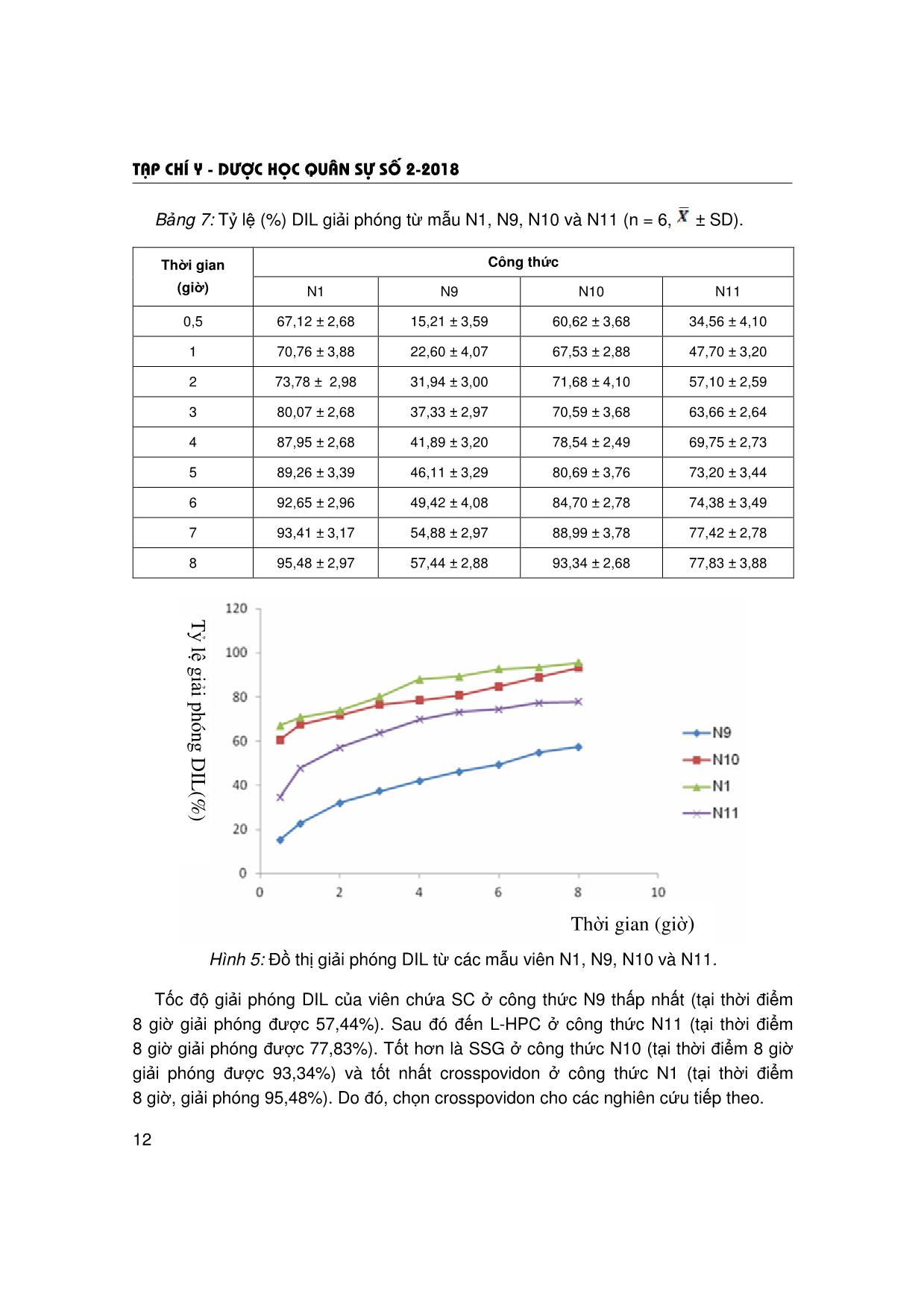
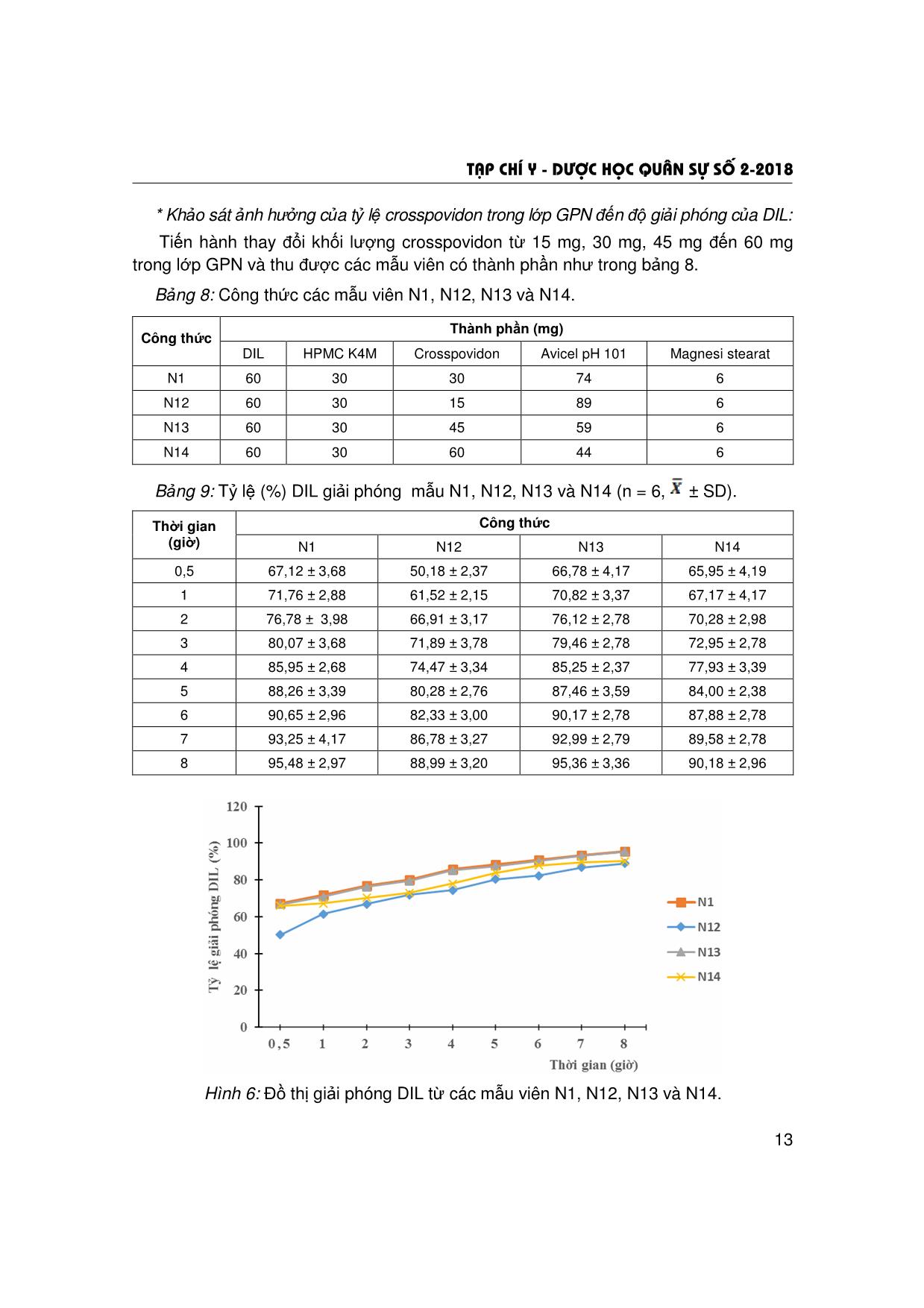
T¹p chÝ y - d−îc häc qu©n sù sè 2-2018 5 ẢNH HƯỞNG CỦA TÁ DƯỢC KIỂM SOÁT GIẢI PHÓNG VÀ TÁ DƯỢC SIÊU RÃ ĐẾN ĐỘ HÒA TAN CỦA VIÊN NÉN HAI LỚP DILTIAZEM HYDROCLORID Trần Thị Hồng Nhung*; Nguyễn Văn Bạch** TÓM TẮT Mục tiêu: khảo sát, lựa chọn loại, tỷ lệ tá dược kiểm soát giải phóng, tá dược siêu rã để xây dựng công thức bào chế viên hai lớp diltiazem hydroclorid (DIL) giải phóng nhanh (GPN) và giải phóng kéo dài (GPKD). Đối tượng: DIL chuẩn hàm lượng 99,9%. Phương pháp: định lượng DIL bằng phương pháp quang phổ hấp thụ UV; bào chế lớp GPN bằng phương pháp dập thẳng và lớp GPKD bằng phương pháp xát hạt ướt; khảo sát ảnh hưởng của các tá dược kiểm soát giải phóng (HPMC K4M, HPMC K100M, gôm xanthan) và tá dược siêu rã (natri croscarmellose, natri starch glycolat, crosspovidon, L-HPC) đến độ hòa tan của viên nén hai lớp DIL. Kết quả: đã thẩm định được phương pháp quang phổ hấp thụ UV để định lượng nồng độ DIL trong môi trường hòa tan có pH 7,5; khảo sát được ảnh hưởng của các tá dược kiểm soát giải phóng và tá dược siêu rã đến độ hòa tan của DIL ra khỏi viên hai lớp. Kết luận: đối với lớp GPKD, HPMC K4M (30%) và đối với lớp GPN, crosspovidon (30%) là những tá dược thích hợp để xây dựng công thức bào chế viên DIL hai lớp GPN và GPKD. * Từ khóa: Diltiazem hydroclorid; Viên nén hai lớp; Tá dược kiểm soát giải phóng; Tá dược siêu rã. Influence of Controlled Release and Superdisintegrants Excipients on the Dissolution of Diltiazem Hydrochloride Bilayer Tablets Summary Objectives: To select the type, the ratio of controlled release excipients and superdisintegrants for formulation of diltiazem hydrochloride (DIL) bilayer tablets (immediate release layer and sustained release layer). Subjects: DIL with content of 99.9%. Methods: Determination of DIL by UV spectrophotometer method; immediate release layer was prepared by a direct compression method and sustained release layer was prepared by a wet granulation method; study on influences of controlled release excipients (HPMC K4M, HPMC K100M, xanthan gum) and superdisintegrants excipients (sodium croscarmelose, sodium starch glycolat, crosspovidon, L-HPC) on the dissolution of DIL bilayer tablets. Results: The UV spectrophotometer method was validated for determination of DIL concentration in the dissolution medium with pH 7.5; influence of controlled release and superdisintegrants excipients on the dissolution DIL bilayer tablets have been evaluated. Conclusion: Using HPMC K4M (ratio of 30%) for sustained release layer and crosspovidon (ratio of 30%) for immediate release layer can be the suitable for development of DIL bilayer tablets formulation. * Keywords: Diltiazem hydrochloride; Bilayer tablets; Controlled release excipients; Superdisintegrants. * Cao đẳng Dược Phú Thọ ** Học viện Quân y Người phản hồi (Corresponding): Nguyễn Văn Bạch (bachqy@yahoo.com) Ngày nhận bài: 25/07/2017; Ngày phản biện đánh giá bài báo: 05/12/2017 Ngày bài báo được đăng: 28/12/2017 T¹p chÝ y - d−îc häc qu©n sù sè 2-2018 6 ĐẶT VẤN ĐỀ Diltiazem hydroclorid là dược chất có tác dụng chẹn kênh canxi, làm giãn động mạch vành và mạch ngoại vi. Trong điều trị, các chế phẩm chứa DIL thường được sử dụng để làm chậm nhịp tim, giảm co bóp cơ tim, làm chậm dẫn truyền nút nhĩ thất và để dự phòng, điều trị cơn đau thắt ngực. Ở các dạng bào chế hiện đại, DIL thường được bào chế dưới dạng viên nén GPN và GPKD. Tuy các dạng thuốc trên có nhiều ưu điểm so với bào chế quy ước, nhưng cũng có những nhược điểm riêng do đặc tính của dạng thuốc. Đối với viên GPN, có đặc điểm nhanh đạt được nồng độ tác dụng trong máu, nhưng cũng nhanh chóng bị đào thải ra khỏi cơ thể. Vì vậy, bệnh nhân (BN) phải dùng thuốc nhiều lần trong ngày. Còn đối với viên GPKD, tuy duy trì được nồng độ điều trị trong máu với thời gian dài, nhưng thời gian đạt được nồng độ điều trị trong máu khá chậm, bất tiện cho BN mắc bệnh cấp tính. Để khắc phục những nhược điểm của hai dạng thuốc trên, hiện nay đã nghiên cứu bào chế viên hai lớp (bilayer tablets) vừa có khả năng GPN vừa có khả năng GPKD [3, 4]. Trong kỹ thuật bào chế viên hai lớp, các tá dược kiểm soát giải phóng và tá dược siêu rã đóng vai trò rất quan trọng đến tốc độ giải phóng dược chất ra khỏi viên hai lớp. Đề tài này, chúng tôi thông báo kết quả nghiên cứu ảnh hưởng của các tá dược kiểm soát giải phóng và tá dược siêu rã đến độ giải phóng của dược chất từ viên DIL hai lớp GPN và GPKD. NGUYÊN VẬT LIỆU VÀ PHƯƠNG PHÁP NGHIÊN CỨU 1. Nguyên vật liệu và thiết bị. * Nguyên liệu và hóa chất: - DIL chuẩn: hàm lượng 99,9%, do Viện Kiểm nghiệm Thuốc Trung ương cung cấp, SKS: 060909. - DIL dược dụng: tiêu chuẩn BP 2009 (Pháp); natri starch glycolat, natri croscarmelose, crosspovidion, L-HPC: tiêu chuẩn BP 2009 (Pháp); HPMC K4M, HPMC K100M, gôm xanthan: tiêu chuẩn USP 30 (Mỹ); polyvinyl pyrolidon 5%, magnesi stearat: tiêu chuẩn BP 2009 (Trung Quốc); avicel PH101; lactose: tiêu chuẩn USP 30 (Ấn Độ). * Thiết bị và dụng cụ: máy đo độ hòa tan Erweka DT-708LH (Đức); máy quang phổ UV-VIS Perkin Elmer LambDIL 25 (Mỹ); máy dập viên tâm sai một chày (Trung Quốc); thiết bị đo độ cứng của viên (Việt Nam); cân phân tích Mettler độ chính xác 0,1 mg; AG 204 Mettler Toledo (Thụy Sỹ); rây cỡ 0,315 mm; tủ sấy Memmert ULM-2001 (Đức); các dụng cụ khác đạt tiêu chuẩn thí nghiệm bào chế và phân tích. 2. Phương pháp nghiên cứu. * Phương pháp bào chế: - Xây dựng công thức cơ bản của viên DIL 60 mg 2 lớp: khối lượng viên 200 mg (lớp GPN: 100 mg, lớp GPKD: 100 mg). Thành phần công thức như sau: + Lớp GPKD (100 mg) gồm: DIL 30 mg; tá dược kiểm soát giải phóng: thay đổi; magnesi stearat 3%; tá dược độn: vừa đủ. T¹p chÝ y - d−îc häc qu©n sù sè 2-2018 7 + Lớp GPN (100 mg) gồm: DIL 30 mg; tá dược siêu rã: thay đổi; magnesi sterat 3%; tá dược độn: vừa đủ. + Khảo sát ảnh hưởng của tá dược kiểm soát giải phóng: HPMC K100M, HPMC K4M và gôm xanthan. + Khảo sát ảnh hưởng của loại tá dược siêu rã: natri croscarmellose, natri starch glycolat, crosspovidon và L-HPC. - Phương pháp bào chế: + Bào chế lớp GPN bằng phương pháp dập thẳng và lớp GPKD bằng phương pháp xát hạt ướt. + Phối hợp hai lớp: đưa lớp GPKD vào cối nén sơ bộ. Dập viên bằng máy dập viên tâm sai, bộ chày cối đường kính 8 mm. Sau đó, thêm lớp GPN, dập thành viên hoàn chỉnh. Để viên ổn định trong 24 giờ trước khi đánh giá độ hòa tan. * Định lượng DIL: bằng phương pháp quang phổ UV [1]: xác định mối tương quan tuyến tính giữa độ hấp thụ và nồng độ dung dịch thông qua giá trị tương quan tuyến tính R2 và độ lặp lại của phương pháp thông qua giá trị độ lệch chuẩn tương đối RSD (%). * Đánh giá độ giải phóng của DIL từ viên hai lớp: theo nguyên tắc của Dược điển Việt Nam IV, phụ lục 11.4 [2], cụ thể: kiểu thiết bị: cánh khuấy; môi trường hòa tan: 900 ml dung dịch đệm phosphat pH 7,5; nhiệt độ môi trường: 37 ± 0,5ºC; tốc độ quay: 50 vòng/phút; thời điểm lấy mẫu: 0,5; 1,0; 2,0; 3,0; 4,0; 6,0; 7,0 và 8,0 giờ. KẾT QUẢ NGHIÊN CỨU VÀ BÀN LUẬN 1. Kết quả thẩm định phương pháp quang phổ UV để định lượng DIL. * Khảo sát điểm cực đại hấp thụ của DIL trong môi trường đệm pH 7,5: - Tiến hành ghi phổ của dung dịch DIL chuẩn có nồng độ 10 µg/ml và dung dịch mẫu trắng (hỗn hợp tá dược). (a) (b) Hình 1: Phổ UV của dung dịch DIL 10 µg/ml (a) và dung dịch hỗn hợp tá dược (b). Phổ dung dịch DIL cho thấy: tại λ = 237,2 nm, xuất hiện một cực đại hấp thụ. Dung dịch hỗn hợp tá dược không xuất hiện đỉnh hấp thụ tại bước sóng này. Như vậy, có 0.0 0.5 1.0 1.5 2.0 Abs 200.0 225.0 250.0 275.0 300.0 325.0 350.0 375.0 400.0 nmSample Description T¹p chÝ y - d−îc häc qu©n sù sè 2-2018 8 thể sử dụng phương pháp quang phổ hấp thụ tử ngoại để xác định nồng độ DIL tại bước sóng λmax = 237,2 nm. - Xây dựng đường chuẩn DIL trong môi trường đệm pH = 7,5. Bảng 1: Sự phụ thuộc giữa độ hấp thụ và nồng độ DIL tại λmax = 237,2 nm (n = 6). Nồng độ Độ (µg/ml) hấp thụ 4 6 8 10 12 A1 0,242 0,332 0,428 0,541 0,634 A2 0,224 0,347 0,438 0,542 0,615 A3 0,236 0,341 0,437 0,532 0,652 A4 0,227 0,334 0,429 0,534 0,637 A5 0,245 0,342 0,428 0,533 0,619 A6 0,239 0,348 0,437 0,547 0,642 0,232 0,338 0,433 0,533 0,645 SD 0,003 0,005 0,006 0,001 0,011 RSD (%) 1,43 1,47 1,31 0,27 1,65 Hình 2: Đường chuẩn biểu diễn mối tương quan giữa độ hấp thụ và nồng độ dung dịch DIL tại λmax = 237,2 nm. Phương trình đường chuẩn có dạng Y = 0,0511X + 0,0278, giá trị R2 = 0,9993 và RSD < 2% (cao nhất 1,47%). Điều đó chứng tỏ có mối tương quan tuyến tính giữa độ hấp thụ và nồng độ dung dịch, độ lặp lại tốt. Vì vậy, có thể sử dụng phương pháp quang phổ UV ở bước sóng λmax = 237,2 nm để định lượng nồng độ DIL trong đánh giá độ hòa tan. 2. Kết quả khảo sát ảnh hưởng của tá dược kiểm soát giải phóng. Thành phần DIL và tá dược như phần phương pháp. Trong đó, cố định crosspovidon với khối lượng 30 mg để khảo sát ảnh hưởng của tá dược kiểm soát giải phóng. Khảo sát 3 loại tá dược kiểm soát giải phóng là: HPMC K4M, HPMC K100M và gôm xanthan với khối lượng 30 mg, thu được các viên có thành phần khác nhau. T¹p chÝ y - d−îc häc qu©n sù sè 2-2018 9 Bảng 2: Thành phần công thức các mẫu viên N1, N2 và N3. Thành phần (mg) Công thức DIL Crosspovidon HPMC K4M HPMC K100M Gôm xanthan Avicel pH 101 Magnesi stearat N1 60 30 30 - - 74 6 N2 60 30 30 - 74 6 N3 60 30 - 30 74 6 Lượng tá dược dính PVP 5% trong ethanol 96% là một yếu tố không khảo sát trong quá trình bào chế, do PVP ít ảnh hưởng đến tốc độ giải phóng DIL của viên. Các mẫu viên sau khi bào chế, tiến hành xác định tốc độ giải phóng DIL. Bảng 3: Tỷ lệ (%) DIL giải phóng của mẫu N1, N2 và N3 (n = 6, ± SD). Công thức Thời gian (giờ) N1 N2 N3 0,5 67,12 ± 3,05 60,28 ± 2,91 64,02 ± 3,01 1 70,76 ± 3,13 62,28 ± 2,14 68,65 ± 2,94 2 73,78 ± 2,89 66,99 ± 3,04 70,77 ± 3,80 3 80,07 ± 3,15 68,76 ± 3,18 76,17 ± 3,08 4 87,95 ± 3,97 69,18 ± 3,09 81,66 ± 3,15 5 89,26 ± 3,63 70,77 ± 3,52 83,04 ± 3,96 6 92,65 ± 3,46 71,91 ± 2,95 85,39 ± 3,46 7 93,41 ± 3,67 75,99 ± 3,27 87,05 ± 3,35 8 95,48 ± 3,77 80,20 ± 3,78 90,26 ± 3,13 Hình 3: Đồ thị giải phóng DIL từ các mẫu viên N1, N2 và N3. T ỷ lệ giải phó ng DIL (%) Thời gian (giờ) T¹p chÝ y - d−îc häc qu©n sù sè 2-2018 10 Ở công thức N2, HPMC K100M cho tốc độ giải phóng DIL chậm (tại thời điểm 8 giờ, giải phóng được 80,20%). Ở công thức N3, viên chứa gôm xanthan tỷ lệ giải phóng DIL các giờ đầu cao hơn viên chứa HPMC K100M (tại thời điểm 0,5 giờ, giải phóng được 64,02%; tại thời điểm 3 giờ là 76,17% và tại thời điểm 5 giờ, giải phóng được 83,04%). Nhưng trong những giờ cuối, tốc độ giải phóng chậm hơn (tại thời điểm 8 giờ, giải phóng được 90,26%) so với viên chứa HPMC K4M (95,48%). Tốc độ giải phóng khác nhau là do HPMC K4M có độ nhớt cao, tan chậm, tạo thành khối gel kiểm soát giải phóng DIL bằng cơ chế khuếch tán. Những giờ đầu, lớp gel chưa kịp hình thành, lượng DIL giải phóng ra nhanh (tại thời điểm 0,5 giờ giải phóng được 67,12%; tại thời điểm 1 giờ giải phóng được 70,76%). Sau vài giờ, khi dung môi thấm sâu vào viên, độ dày của lớp khuếch tán tăng lên. Do đó, tốc độ DIL giải phóng trong các giờ sau chậm hơn so với những giờ đầu (tại thời điểm 6 giờ giải phóng được 92,65%, tại thời điểm 7 giờ là 93,41%). Vì vậy, lựa chọn HPMC K4M làm tá dược điều khiển giải phóng cho các mẫu nghiên cứu tiếp theo. * Ảnh hưởng của hàm lượng HPMC K4M đến độ hòa tan DIL trong viên: Bảng 4: Công thức các mẫu viên từ N4 đến N8. Thành phần (mg) Công thức DIL HPMC K4M Crosspovidon Avicel pH101 Magnesi stearat N4 60 10 30 94 6 N5 60 20 30 84 6 N6 60 30 30 74 6 N7 60 40 30 64 6 N8 60 60 30 44 6 Bảng 5: Tỷ lệ (%) DIL giải phóng mẫu viên từ N4 đến N8 (n = 6, ± SD). Công thức Thời gian (giờ) N4 N5 N6 N7 N8 0,5 70,04 ± 3,17 68,33 ± 3,76 64,78 ± 4,17 60,94 ± 2,37 52,76 ± 3,78 1 72,81 ± 2,59 71,75 ± 3,00 66,16 ± 3,37 60,07 ± 4,00 59,94 ± 2,59 2 85,12 ± 2,95 80,82 ± 2,56 73,99 ± 2,78 68,26 ± 3,59 62,39 ± 2,59 3 89,00 ± 3,76 86,77 ± 3,17 75,11 ± 3,78 70,82 ± 3,39 67,09 ± 3,59 4 92,00 ± 3,95 89,68 ± 4,20 79,91 ± 3,37 74,49 ± 3,76 69,68 ± 3,09 5 93,32 ± 3,55 90,82 ± 3,59 82,40 ± 2,59 78,09 ± 3,78 70,82 ± 2,76 6 99,15 ± 2,45 96,18 ± 3,56 87,30 ± 3,73 83,89 ± 3,76 72,07 ± 2,56 7 99,87 ± 3,76 98,14 ± 2,59 91,65 ± 3,59 85,35 ± 3,17 74,98 ± 3,37 8 101,82 ± 3,84 100,60 ± 3,39 94,56 ± 2,36 86,66 ± 3,78 76,44 ± 4,32 T¹p chÝ y - d−îc häc qu©n sù sè 2-2018 11 Hình 4: Đồ thị giải phóng DIL từ mẫu viên từ N4 đến N8. Ở công thức N4 và N5 (hàm lượng HPMC K4M là 10 mg và 20 mg), tốc độ giải phóng DIL cao (tại thời điểm 2 giờ giải phóng được 85,12 và 80,82%, tại thời điểm 8 giờ giải phóng được 101,8 và 100,60%). Ngược lại, ở công thức N7 và N8 (hàm lượng HPMC K4M là 40 mg và 60 mg), tốc độ giải phóng DIL chậm (tại thời điểm 2 giờ giải phóng được 68,26 và 62,39%, còn tại thời điểm 8 giờ là 86,66 và 76,44%). Chỉ ở công thức N6 (hàm lượng HPMC K4M 30 mg), tốc độ giải phóng DIL phù hợp với mô hình của viên nén 2 lớp chứa lớp giải phóng nhanh và giải phóng kéo dài (tại thời điểm 2 giờ, giải phóng được 73,99% và tại thời điểm 8 giờ là 94,66%) [5]. Vì vậy, chọn hàm lượng 30 mg HPMC K4M (tương đương 30% khối lượng của lớp GPKD) cho các nghiên cứu tiếp theo. 3. Kết quả khảo sát ảnh hưởng của tá dược siêu rã. * Đối với tá dược siêu rã, lựa chọn 4 loại: natri croscarmellose (SC), natri starch glycolate (SSG), crosspovidon và L-HPC với hàm lượng 30 mg: Bảng 6: Thành phần công thức các mẫu viên N1, N9, N10 và N11. Thành phần (mg) Công thức DIL HPMC K4M Crosspovidon SC SSG L-HPC Avicel pH101 Magnesi stearat N1 60 30 30 - - - 74 6 N9 60 30 - 30 - - 74 6 N10 60 30 - - 30 - 74 6 N11 60 30 - - - 30 74 6 T¹p chÝ y - d−îc häc qu©n sù sè 2-2018 12 Bảng 7: Tỷ lệ (%) DIL giải phóng từ mẫu N1, N9, N10 và N11 (n = 6, ± SD). Công thức Thời gian (giờ) N1 N9 N10 N11 0,5 67,12 ± 2,68 15,21 ± 3,59 60,62 ± 3,68 34,56 ± 4,10 1 70,76 ± 3,88 22,60 ± 4,07 67,53 ± 2,88 47,70 ± 3,20 2 73,78 ± 2,98 31,94 ± 3,00 71,68 ± 4,10 57,10 ± 2,59 3 80,07 ± 2,68 37,33 ± 2,97 70,59 ± 3,68 63,66 ± 2,64 4 87,95 ± 2,68 41,89 ± 3,20 78,54 ± 2,49 69,75 ± 2,73 5 89,26 ± 3,39 46,11 ± 3,29 80,69 ± 3,76 73,20 ± 3,44 6 92,65 ± 2,96 49,42 ± 4,08 84,70 ± 2,78 74,38 ± 3,49 7 93,41 ± 3,17 54,88 ± 2,97 88,99 ± 3,78 77,42 ± 2,78 8 95,48 ± 2,97 57,44 ± 2,88 93,34 ± 2,68 77,83 ± 3,88 Hình 5: Đồ thị giải phóng DIL từ các mẫu viên N1, N9, N10 và N11. Tốc độ giải phóng DIL của viên chứa SC ở công thức N9 thấp nhất (tại thời điểm 8 giờ giải phóng được 57,44%). Sau đó đến L-HPC ở công thức N11 (tại thời điểm 8 giờ giải phóng được 77,83%). Tốt hơn là SSG ở công thức N10 (tại thời điểm 8 giờ giải phóng được 93,34%) và tốt nhất crosspovidon ở công thức N1 (tại thời điểm 8 giờ, giải phóng 95,48%). Do đó, chọn crosspovidon cho các nghiên cứu tiếp theo. T ỷ lệ giải phó ng D IL(%) Thời gian (giờ) T¹p chÝ y - d−îc häc qu©n sù sè 2-2018 13 * Khảo sát ảnh hưởng của tỷ lệ crosspovidon trong lớp GPN đến độ giải phóng của DIL: Tiến hành thay đổi khối lượng crosspovidon từ 15 mg, 30 mg, 45 mg đến 60 mg trong lớp GPN và thu được các mẫu viên có thành phần như trong bảng 8. Bảng 8: Công thức các mẫu viên N1, N12, N13 và N14. Thành phần (mg) Công thức DIL HPMC K4M Crosspovidon Avicel pH 101 Magnesi stearat N1 60 30 30 74 6 N12 60 30 15 89 6 N13 60 30 45 59 6 N14 60 30 60 44 6 Bảng 9: Tỷ lệ (%) DIL giải phóng mẫu N1, N12, N13 và N14 (n = 6, ± SD). Công thức Thời gian (giờ) N1 N12 N13 N14 0,5 67,12 ± 3,68 50,18 ± 2,37 66,78 ± 4,17 65,95 ± 4,19 1 71,76 ± 2,88 61,52 ± 2,15 70,82 ± 3,37 67,17 ± 4,17 2 76,78 ± 3,98 66,91 ± 3,17 76,12 ± 2,78 70,28 ± 2,98 3 80,07 ± 3,68 71,89 ± 3,78 79,46 ± 2,78 72,95 ± 2,78 4 85,95 ± 2,68 74,47 ± 3,34 85,25 ± 2,37 77,93 ± 3,39 5 88,26 ± 3,39 80,28 ± 2,76 87,46 ± 3,59 84,00 ± 2,38 6 90,65 ± 2,96 82,33 ± 3,00 90,17 ± 2,78 87,88 ± 2,78 7 93,25 ± 4,17 86,78 ± 3,27 92,99 ± 2,79 89,58 ± 2,78 8 95,48 ± 2,97 88,99 ± 3,20 95,36 ± 3,36 90,18 ± 2,96 Hình 6: Đồ thị giải phóng DIL từ các mẫu viên N1, N12, N13 và N14. T¹p chÝ y - d−îc häc qu©n sù sè 2-2018 14 Khi tăng lượng crosspovidon, tỷ lệ (%) DIL giải phóng cũng tăng (viên chứa 15 mg có tốc độ giải phóng DIL tại thời điểm 8 giờ đạt 88,99%, khi tăng lên 30 mg, DIL giải phóng được 95,36%). Ở công thức 13 (viên chứa 45 mg crosspovidon), tỷ lệ giải phóng DIL tại thời điểm 2 giờ và 8 giờ tương đương như ở công thức N1. Sự khác biệt không có ý nghĩa thống kê (p > 0,05). Nếu tiếp tục tăng quá mức, tỷ lệ DIL giải phóng lại có xu hướng giảm (viên chứa 60 mg crosspovidon có tỷ lệ giải phóng DIL tại thời điểm 8 giờ là 90,18%). Điều này được giải thích: khi tăng lượng crosspovidon quá mức, viên tạo ra có hệ thống vi mao quản ít hơn, độ xốp giảm đi nhiều. Đồng thời, cũng tạo ra một hàng rào gel khi tiếp xúc với môi trường hòa tan, làm cản trở hút nước vào trong lòng viên. Vì thế, khả năng giải phóng DIL của viên không tăng lên mà còn có thể giảm đi. Để thuận tiện trong bào chế và đảm bảo tỷ lệ giải phóng DIL của viên, chúng tôi chọn khối lượng crosspovidon 30 mg để xây dựng công thức bào chế viên hai lớp DIL GPN và GPKD. KẾT LUẬN Đã khảo sát ảnh hưởng của một số tá dược kiểm soát giải phóng (HPMC K4M, HPMC K100M, gôm xanthan) và tá dược siêu rã (natri croscarmellose, natri starch glycolat, crosspovidon, L-HPC) đến tốc độ GPN và GPKD từ viên DIL hai lớp. Kết quả nghiên cứu cho thấy: đối với lớp GPKD, tá dược kiểm soát giải phóng HPMC K4M với tỷ lệ 30% (30 mg HPMC K4M/100 mg lớp GPKD) và đối với lớp GPN, tá dược siêu rã crosspovidon với tỷ lệ 30% (30 mg crosspovidon/100 mg lớp GPN) là những thông số hợp lý để xây dựng công thức bào chế viên hai lớp DIL GPN và GPKD. TÀI LIỆU THAM KHẢO 1. Nguyễn Văn Bạch. Nghiên cứu bào chế và đánh giá sinh khả dụng viên nén diltiazem hydrochlorid 60 mg giải phóng theo nhịp. Luận án Tiến sỹ Dược học. Học viện Quân y. 2012, tr.56-57. 2. Bộ Y tế. Dược điển Việt Nam IV. PL 11.4, tr.222-225. 3. Pridhivikrishna Kottu. Design and evaluation of bilayer matrix tablets of sustained release glimepiride and pioglitazone. Master of Pharmacy in Pharmaceutics. KLE University. 2012. 4. Raj S. Brito. Design and evaluation of sustained release bilayer tablet of metformin. Department of Pharmaceutics. Sri Venkateswara College of Pharmacy. Chittoor A.P. India. 2011. 5. Admassu Abebea, Ilgaz Akselib, Omar Sprockela et al. Review of bilayer tablet technology. International Journal of Pharmaceutics. 2014, 461 (1 - 2), pp.549-558.
File đính kèm:
 anh_huong_cua_ta_duoc_kiem_soat_giai_phong_va_ta_duoc_sieu_r.pdf
anh_huong_cua_ta_duoc_kiem_soat_giai_phong_va_ta_duoc_sieu_r.pdf

